- 醫療器械注冊
- 第二類醫療器械注冊 第三類醫療器械注冊 進口醫療器械注冊 第一類醫療器械備案 體外診斷試劑注冊 醫療器械產品技術要求 醫療器械生產許可證
- 醫療器械CE認證
- 醫療器械CE認證 FDA注冊(備案) 醫療器械境外注冊服務 ISO13485認證 ISO15378醫療包材體系認證 MDSAP認證服務 ISO13485內審員培訓
- 醫療器械臨床試驗
- 醫療器械臨床試驗服務 同品種比對臨床評價 體外診斷試劑(IVD)臨床試驗服務 臨床協調員(CRC)服務 進口醫療器械補充臨床試驗服務 醫院臨床試驗機構備案服務 醫療器械可用性工程文檔編制
- 醫療器械經營許可
- 醫療器械經營許可證辦理 第二類醫療器械經營備案 醫療器械網絡銷售備案 醫療器械分類界定代辦 醫療器械飛行檢查服務 醫療器械主文檔登記代辦 醫療器械創新申報代辦
- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
國家藥監局關于第一類醫療器械備案有關事項的公告(2022年第62號) 2022年8月11日,為做好第一類醫療器械備案工作,根據《醫療器械監督管理條例》(國務院令第739號)、《醫療器械注冊與備案管理辦法》(國家市場監督管理總局令第47號)、《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號),國際藥監局發布關于第一類醫療器械備案有關事項的公告(2022年第62號)。 時間:2022-8-12 10:16:16 瀏覽量:5755

-
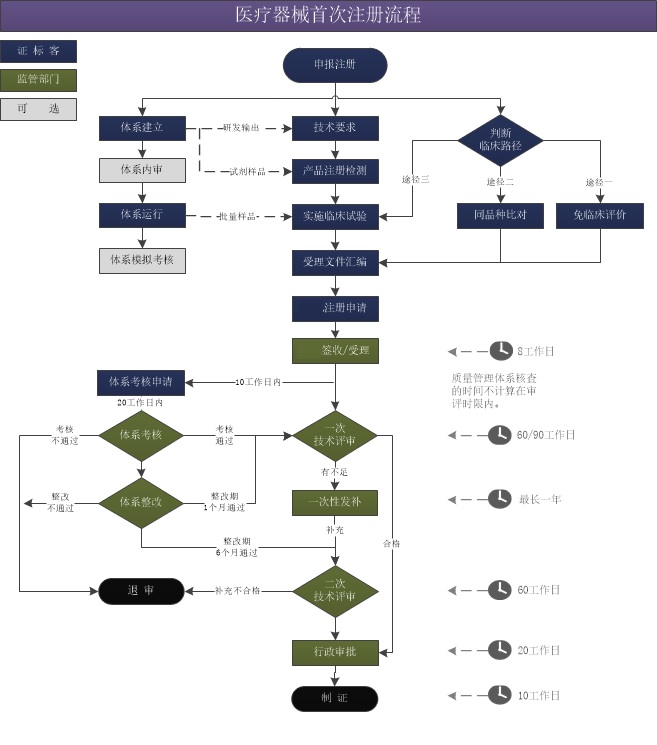
醫療器械注冊審評流程圖 醫療器械注冊審評是醫療器械注冊關鍵事項之一,了解注冊審評流程將有助于我們理解注冊審評,更好的控制醫療器械注冊項目風險。 時間:2022-6-15 20:41:38 瀏覽量:4330
-
新型冠狀病毒(2019-nCoV)抗原檢測試劑注冊審查指導原則(2022年第18號) 2022年4月27日,為進一步規范新型冠狀病毒相關檢測試劑的管理,國家藥監局器審中心組織制定并發布了《新型冠狀病毒(2019-nCoV)抗原檢測試劑注冊審查指導原則》(2022年第18號),詳見正文。 時間:2022-4-28 14:38:08 瀏覽量:6400
-
新型冠狀病毒(2019-nCoV)抗體檢測試劑注冊審查指導原則(2022年第18號) 2022年4月27日,為進一步規范新型冠狀病毒相關檢測試劑的管理,國家藥監局器審中心組織制定并發布了《新型冠狀病毒(2019-nCoV)抗體檢測試劑注冊審查指導原則》(2022年第18號),詳見正文。 時間:2022-4-28 14:32:53 瀏覽量:3951

-
新型冠狀病毒(2019-nCoV)核酸檢測試劑注冊審查指導原則(2022年第18號) 2022年4月27日,為進一步規范新型冠狀病毒相關檢測試劑的管理,國家藥監局器審中心組織制定并發布了《新型冠狀病毒(2019-nCoV)核酸檢測試劑注冊審查指導原則》,詳見正文。 時間:2022-4-28 14:27:18 瀏覽量:5240
-
醫療器械注冊人制度各省監管職責分工表 除了醫療器械注冊人制度監管職責分工明確之外,第一類醫療器械跨省市備案亦參照上圖執行。 時間:2022-4-28 14:17:57 瀏覽量:5069

-
醫療器械軟件注冊審查指導原則(2022年修訂版)(2022年第9號) 為進一步規范醫療器械軟件注冊的管理,國家藥監局器審中心組織制定了醫療器械軟件注冊審查指導原則(2022年修訂版)(2022年第9號),并與2022年3月9日發布。 時間:2022-3-13 17:11:10 瀏覽量:8992
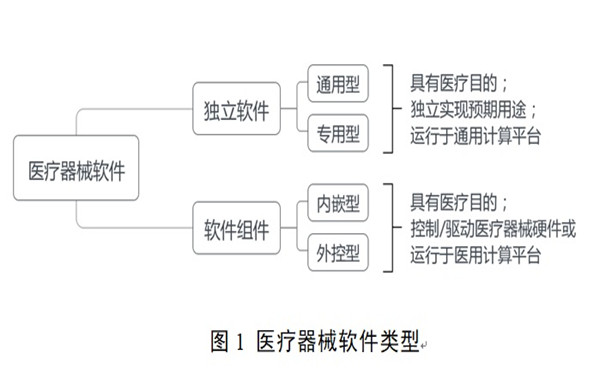
-
醫療器械網絡安全注冊審查指導原則2022年修訂版 醫療器械網絡安全注冊審查指導原則(2022年修訂版) ,旨在指導注冊申請人規范醫療器械網絡安全生存周期過程和準備醫療器械網絡安全注冊申報資料,同時規范醫療器械網絡安全的技術審評要求,為醫療器械軟件、質量管理軟件的體系核查提供參考。 時間:2022-3-9 11:09:07 瀏覽量:5559
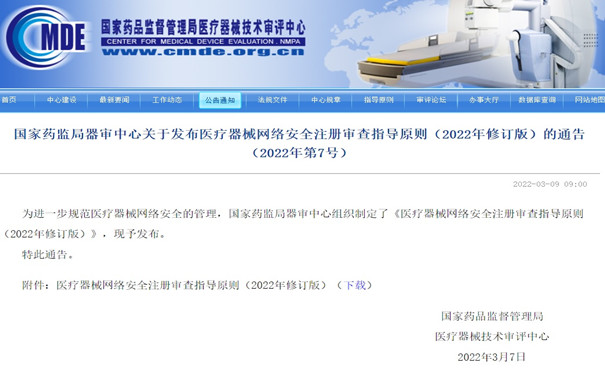
-
人工智能醫療器械注冊審查指導原則(2022年第8號) 人工智能醫療器械注冊審查指導原則(2022年第8號),旨在指導注冊申請人建立人工智能醫療器械生存周期過程和準備人工智能醫療器械注冊申報資料,同時規范人工智能醫療器械的技術審評要求,為人工智能醫療器械、質量管理軟件的體系核查提供參考。 時間:2022-3-9 10:59:05 瀏覽量:4190

-
動物源性醫療器械注冊技術審查指導原則(2017年修訂版) 動物源性醫療器械注冊技術審查指導原則(2017年修訂版) ,本指導原則是對注冊申請人和醫療器械相關管理部門技術審評人員的指導性文件,不限制相關管理部門對該類產品的技術審評以及注冊申請人對注冊申報資料的準備工作。本指導原則不包括注冊審批所涉及的行政事項,亦不作為法規強制執行。 時間:2022-2-15 18:26:25 瀏覽量:4063

-
第一類醫療器械產品目錄 為貫徹落實《醫療器械監督管理條例》(國務院令第739號)要求,進一步指導第一類醫療器械備案工作,國家藥品監督管理局組織修訂了《第一類醫療器械產品目錄》,現予發布。該目錄自2022年1月1日起施行。 時間:2022-1-16 12:30:36 瀏覽量:4616
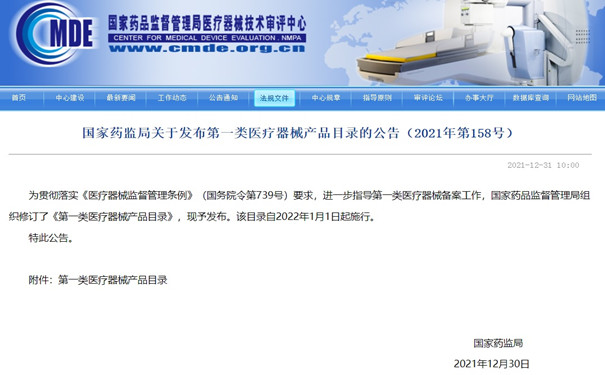
-
藥監總局醫療器械注冊審評老師聯系電話 醫療器械注冊第三方服務 時間:2022-1-12 15:30:58 瀏覽量:20530

-
山東省醫療器械工藝用水現場檢查指南 山東省醫療器械工藝用水現場檢查指南 時間:2022-1-7 9:25:12 瀏覽量:3599
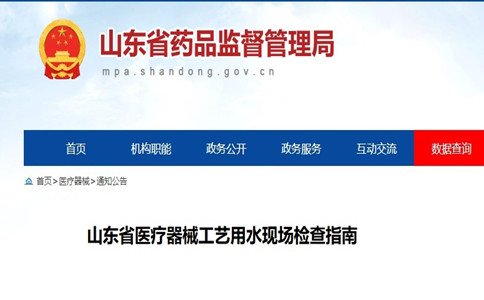
-
山東省醫療器械潔凈室(區)現場檢查指南 山東省醫療器械潔凈室(區)現場檢查指南 時間:2022-1-7 9:19:11 瀏覽量:3241
-
國家藥監局關于實施《第一類醫療器械產品目錄》有關事項的通告(2021年第107號) 國家藥監局關于實施《第一類醫療器械產品目錄》有關事項的通告(2021年第107號) 時間:2022-1-1 15:58:17 瀏覽量:3446

-
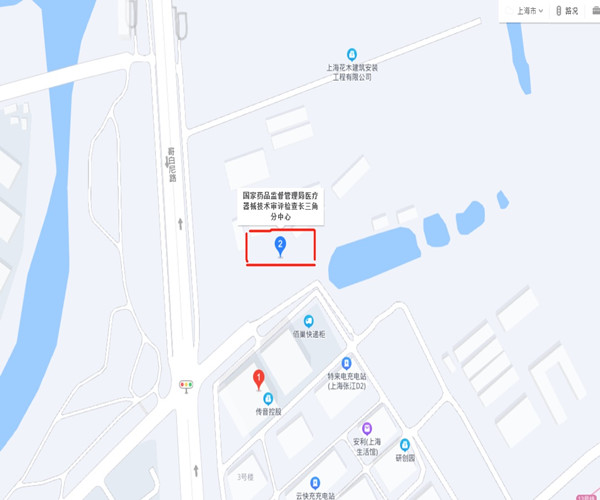
醫療器械技術審評檢查長三角分中心電話和地址 醫療器械技術審評檢查長三角分中心電話和地址 時間:2021-10-14 13:00:15 瀏覽量:5168
-
醫療器械注冊證(體外診斷試劑)內容和格式 醫療器械注冊證(體外診斷試劑)內容和格式 時間:2021-10-4 11:45:31 瀏覽量:4399

-
醫療器械注冊證內容和格式 醫療器械注冊證內容和格式 時間:2021-10-4 11:40:11 瀏覽量:5698

-
《第一類醫療器械產品目錄》修訂草案(征求意見稿) 2021年8月18日,國家藥監局綜合司發布《第一類醫療器械產品目錄》修訂草案(征求意見稿),面向公眾公開征求意見。 時間:2021-8-21 16:22:31 瀏覽量:2788

-
第三類醫療器械注冊流程 根據《醫療器械監督管理條例》(國務院令第650號)的規定,對醫療器械按照風險程度實行分類管理。 第Ⅰ類是風險程度低,境內生產企業需要在所在地市藥監局進行備案,境外醫療器械生產企業需要委托境內代理人在NMPA進行備案。第二類是具有中度風險,境內生產企業需要在所在地省(直轄市)藥監局進行注冊,境外醫療器械生產企業需要委托境內代理人在NMPA進行注冊。第三類類是具有較高風險,均需要在NMPA進行注冊。 時間:2021-8-16 18:41:04 瀏覽量:8379