- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
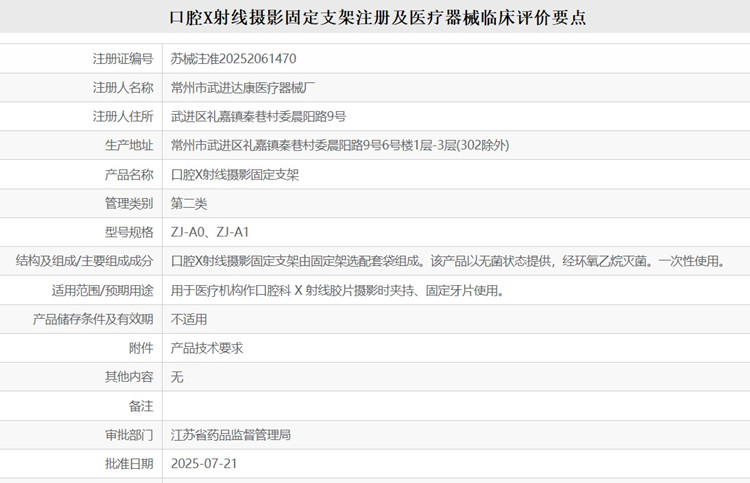
口腔 X 射線攝影固定支架注冊及醫療器械臨床評價要點 用于醫療機構作口腔科 X 射線膠片攝影時夾持、固定牙片使用的口腔 X 射線攝影固定支架,我國歸屬于第二類醫療器械注冊管理。口腔 X 射線攝影固定支架由固定架選配套袋組成。該產品以無菌狀態提供,經環氧乙烷滅菌。一次性使用。本文為大家介紹口腔 X 射線攝影固定支架注冊及醫療器械臨床評價要點,一起看正文。 時間:2025-8-30 0:00:00 瀏覽量:317
-
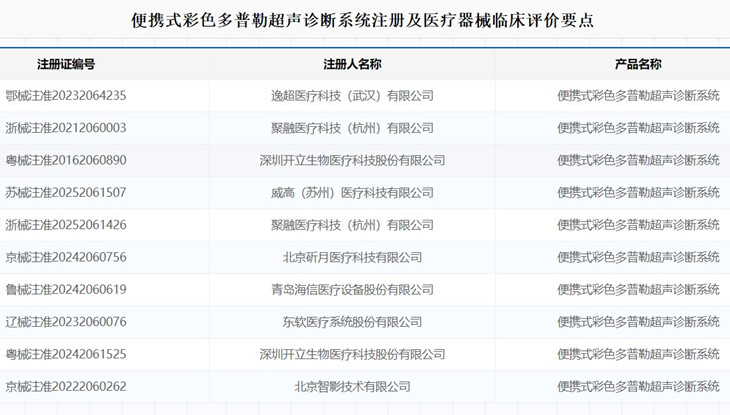
便攜式彩色多普勒超聲診斷系統注冊及醫療器械臨床評價要點 在醫療機構中,用于臨床超聲診斷檢查的便攜式彩色多普勒超聲診斷系統,在我國屬于第二類醫療器械注冊產品,產品由主機、探頭、適配器、電源線和鋰電池組成。 硬件選配包含:CW 板、移動式推車、推車電池、探頭擴展器、耦合劑加熱器、腳踏 開關、視頻轉接盒、可移動 DVD 刻錄光驅、無線網卡、穿刺架。本為便攜式彩色多普勒超聲診斷系統注冊及醫療器械臨床評價要點,一起看正文。 時間:2025-8-30 0:00:00 瀏覽量:339
-
上海市第二類創新醫療器械特別審查資料申報環節合規指引(下) 接著上一篇文章,本繼續為大家講解上海市第二類創新醫療器械特別審查資料申報環節合規指引的下半部分內容,一起看正文。 時間:2025-8-29 0:00:00 瀏覽量:313

-
上海市第二類創新醫療器械特別審查資料申報環節合規指引(上) 為保障醫療器械臨床使用需求,進一步優化本市醫療器械審評審批程序,鼓勵以臨床價值為導向的醫療器械研發,建立更加科學、高效的醫療器械審評審批體系,在原《上海市第二類創新醫療器械特別審查程序》內容基礎上,2025年7月上海市藥品監督管理局發布《上海市第二類創新醫療器械特別審查程序》,自2025年9月1日起實施。 時間:2025-8-29 0:00:00 瀏覽量:310

-
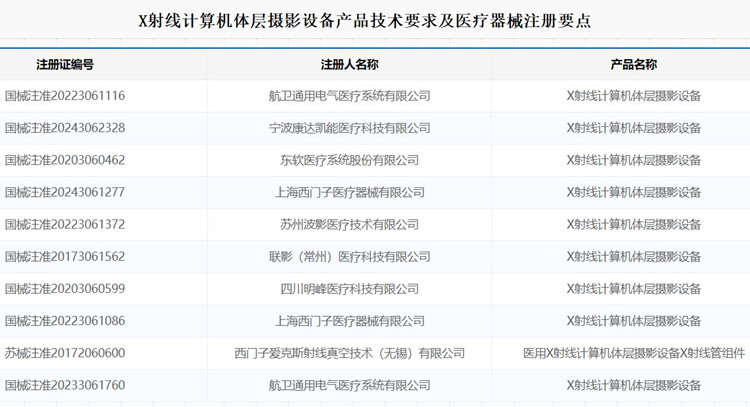
X射線計算機體層攝影設備產品技術要求及醫療器械注冊要點 用于常規 CT 檢查,支持冠狀動脈 CT 血管造影 和能譜檢查的X射線計算機體層攝影設備,在我國屬于第三類醫療器械注冊產品。該產品由掃描架、高壓發生器、X 射線管組件、光子計 數探測器、檢查床、激光定位燈、控制臺、限束器、選配 件和附件組成。一起來看X射線計算機體層攝影設備產品技術要求及醫療器械注冊要點。 時間:2025-8-28 0:00:00 瀏覽量:358
-
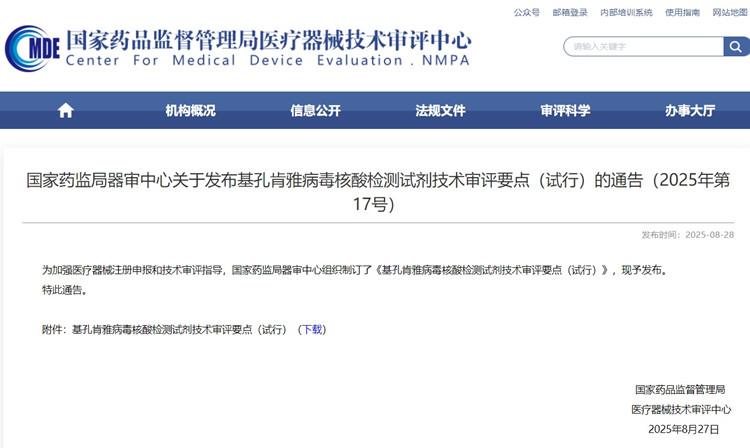
基孔肯雅病毒核酸檢測試劑技術審評要點(試行)(2025年第17號) 2025年8月28日,為加強醫療器械注冊申報和技術審評指導,國家藥監局器審中心組織制訂了《基孔肯雅病毒核酸檢測試劑技術審評要點(試行)》,現予發布,一起來看具體內容。 時間:2025-8-28 0:00:00 瀏覽量:381
-
遠紅外熱敷貼注冊及同品種臨床評價要點 用于緩解女性宮寒、小腹冷痛的遠紅外熱敷貼,在我國屬于第二類醫療器械注冊產品。遠紅外熱敷貼由遠紅外布、發熱袋、固定膠帶組成,發熱袋由鐵粉、活性炭、鹽、 蛭石、樹脂、水組成。該產品以非無菌狀態提供,一次性使用。本文為大家介紹 遠紅外熱敷貼注冊及同品種臨床評價要點,一起看正文。 時間:2025-8-27 0:00:00 瀏覽量:449
-
神經肌肉電刺激儀注冊及同品種臨床評價要點 適用于部分失神經、完全失神經的治療的神經肌肉電刺激儀,在我國屬于第二類醫療器械注冊產品。神經肌肉電刺激儀由主機、輸出電纜、電極組成;其中電極采用外購有醫療器械備案憑證或注冊證的產品,本文為大家介紹神經肌肉電刺激儀注冊及同品種臨床評價要點,一起看正文。 時間:2025-8-27 0:00:00 瀏覽量:401

-
電子陰道視檢鏡注冊及同品種臨床評價要點 適用于臨床對外陰、陰道部位的情況進行放大觀察和疾病的檢查,并進行圖像記錄的電子陰道視檢鏡,在我國屬于第二類醫療器械注冊產品。電子陰道視檢鏡由主機、線纜及軟件(電子陰道視檢軟件,WL MM 01、WL MM 02、WL MM 03、WL MM 04、WL MM 05、WL MM 06,發布版本 1)組成,本文為大家介紹電子陰道視檢鏡注冊及同品種臨床評價要點,一起看正文。 時間:2025-8-26 0:00:00 瀏覽量:375

-
動靜態平衡評估及訓練系統注冊及同品種臨床評價要點 用于對平衡能力障礙患者進行評估和康復訓練的動靜態平衡評估及訓練系統,在我國屬于第二類醫療器械注冊產品,動靜態平衡評估及訓練系統由支撐臺、支撐椅、平衡板、手握持裝置、腰部防護帶、 穿戴式傳感器、顯示和控制裝置、專用軟件組成。本文為大家介紹動靜態平衡評估及訓練系統注冊及同品種臨床評價要點,一起看正文。 時間:2025-8-26 20:18:44 瀏覽量:382

-
帶潤滑涂層第二類血管內導絲注冊答疑1項 帶潤滑涂層歸屬于第二類醫療器械注冊管理的II類血管內導絲,若因涂層材料導致申報產品某項化學性能(如PH、蒸發殘渣、還原物質、紫外吸光度)結果異常時應如何處理,是否仍需要在產品技術要求中制定該項性能要求? 時間:2025-8-25 0:00:00 瀏覽量:260

-
國產第二類醫療器械注冊電子化申報功能詳解(一):補正資料預審查 為持續優化首都醫療器械產業營商環境,提高政務服務效率,北京市藥品監督管理局于2024年11月上線新版行政許可系統,通過在系統中嵌入受理前服務、補正資料預審查等創新功能,成功縮短了申請人各類事項辦理周期。為進一步優化醫療器械審評審批服務,提升申請人注冊申報效率,市器械審查中心對申請人咨詢較多的電子化申報問題進行了總結歸納。 時間:2025-8-25 22:08:32 瀏覽量:359
-
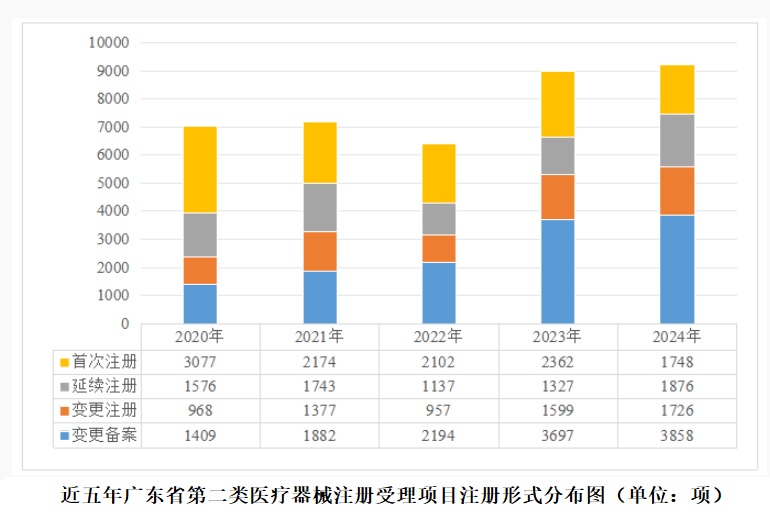
2024年廣東省第二類醫療器械注冊申請受理情況 來自廣東省藥品監督管理局近日披露的消息,2024年,廣東省藥監局依職責受理第二類醫療器械首次注冊、延續注冊、變更注冊和變更備案申請共計9208項,與2023年相比增加2.5%。近五年廣東省受理第二類醫療器械注冊情況,一起見正文。 時間:2025-8-24 0:00:00 瀏覽量:289
-
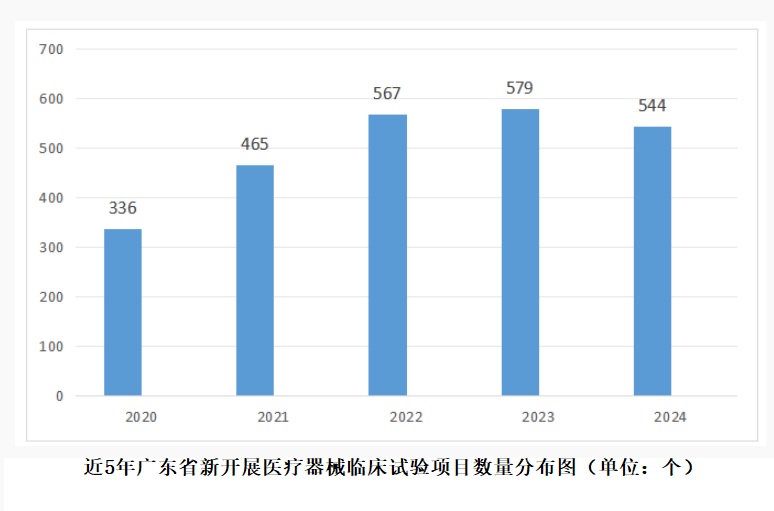
2024年度廣東省醫療器械臨床試驗機構與項目備案情況 截至2024年底,廣東省醫療器械臨床試驗機構備案總數達164家,占全國已備案總數量的11.0%,居全國第一。2024年新增備案機構25家,與2023年相比增加18.0%。 時間:2025-8-23 0:00:00 瀏覽量:315
-
2024年度廣東省醫療器械注冊整體情況 截至2024年底,廣東省醫療器械生產企業4883家,其中生產第二、三類醫療器械生產企業3066家,占全國生產許可證總數量的15.6%,居全國第一。與上一年相比第二、三類生產企業新增44家,第一類生產企業減少193家。醫療器械注冊及備案產品共38176個,其中第二、三類醫療器械注冊證18286個,占全國注冊證總數量的14.5%,居全國第二。已獲批第三類創新醫療器械注冊證42個,居全國第三。 時間:2025-8-23 0:00:00 瀏覽量:331

-
結直腸癌篩查體外診斷試劑臨床評價注冊審查指導原則(2025年第16號) 2025年8月20日,為進一步規范癌癥篩查體外診斷試劑等產品的管理,國家藥監局器審中心組織制修定了《結直腸癌篩查體外診斷試劑臨床評價注冊審查指導原則》,一起來看具體內容。 時間:2025-8-22 17:35:11 瀏覽量:405

-
癌癥篩查體外診斷試劑臨床評價注冊審查指導原則(2025年第16號) 2025年8月20日,為進一步規范癌癥篩查體外診斷試劑等產品的管理,國家藥監局器審中心組織制修定了《癌癥篩查體外診斷試劑臨床評價注冊審查指導原則》,一起來看具體內容。 時間:2025-8-22 17:19:42 瀏覽量:454

-
醫療器械注冊人可以將產品研發和受托生產委托給同一個企業嗎? 醫療器械注冊人制度是近年醫療行業重要改革事項之一,問到醫療器械注冊人制度具體實施相關事項的客戶朋友也是非常多。我會不定期的挑選典型事項給大家解答、分享,今天來說個研發和生產都外包的情形,一起看正文。 時間:2025-8-21 17:11:23 瀏覽量:348

-
有源醫療器械首次注冊,環境試驗的運輸測試做完后,技術要求性能需要全部測試嗎 對于有源醫療器械注冊產品來說,性能檢測完成之后還需要進行環境試驗,之前通常是把環境試驗要求寫入產品技術要求,近期多數醫療器械檢驗機構要求把環境試驗從產品技術要求中剝離出來,獨立檢驗。本文為大家介紹一個環境試驗相關高頻問到的事項,一起看正文。 時間:2025-8-21 0:00:00 瀏覽量:410

-
國家藥監局2025年7月批準進口醫療器械注冊產品50項 來自國家藥監局2025年8月19日披露的數據。2025年7月,國家藥監局共批準注冊醫療器械產品295個。其中,境內第三類醫療器械產品240個,進口第三類醫療器械注冊產品21個,進口第二類醫療器械注冊產品29個,港澳臺醫療器械注冊產品5個,一起來看具體內容。 時間:2025-8-20 0:00:00 瀏覽量:486

