- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
葡萄糖檢測試劑注冊審查指導原則(征求意見稿) 《葡萄糖檢測試劑注冊審查指導原則(征求意見稿)》旨在指導醫療器械注冊申請人對葡萄糖檢測試劑注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。本指導原則是對葡萄糖檢測試劑的一般要求,申請人應依據產品的具體特性確定其中的具體內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特征對注冊申報資料的內容進行充實和細化。 時間:2023/11/13 20:27:56 瀏覽量:1266

-
支氣管堵塞器注冊審查指導原則(征求意見稿) 《支氣管堵塞器注冊審查指導原則(征求意見稿)》旨在指導醫療器械注冊申請人對支氣管堵塞器注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。本指導原則是對支氣管堵塞器的一般要求,申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2023/11/13 0:00:00 瀏覽量:1146

-
病理圖像人工智能分析軟件性能評價審評要點 病理圖像人工智能分析軟件是指基于數字病理圖像,采用深度學習等人工智能技術實現對病理圖像的分割、檢測等功能的獨立軟件,按照第三類醫療器械注冊管理。數字病理圖像包括經數據成像設備獲得的顯微鏡下細胞或組織圖像、全玻片數字掃描技術(WSI)的病理圖像等。產品在醫療機構和/或醫學實驗室使用,可輔助病理醫師為疾病的診斷、預后、治療等提供信息,不能作為臨床診斷決策的唯一依據。 時間:2023/11/13 19:56:15 瀏覽量:1329

-
上海第二類醫療器械變更注冊常見問題 上海第二類醫療器械變更注冊最常見發補問題是對變更內容的驗證和確認不夠充分,或表述不規范。大部分問題與前文首次醫療器械注冊常見問題相同,不再贅述。 時間:2023/11/11 11:15:02 瀏覽量:1288

-
上海第二類醫療器械注冊(首次注冊)常見問題 上海第二類醫療器械注冊(首次注冊)常見發補問題包括綜述資料常見發補問題、非臨床資料常見發補問題、臨床資料常見發補問題(含同品種臨床評價)、產品說明書和標簽樣稿常見發補問題四個部分,具體見正文。 時間:2023/11/11 11:08:40 瀏覽量:1462

-
上海第二類醫療器械延續注冊形式審查常見問題 2023年1月1日,上海市醫療器械注冊電子申報系統上線,器審中心在受理注冊申報資料前對上海市第二類醫療器械延續注冊進行形式審查,發現注冊申報資料中存在一些較為普遍的問題。為了幫助醫療器械注冊人進一步提升申報資料質量,下面將對形式審查中的共性問題進行分析匯總以供參考。 時間:2023/11/11 10:45:42 瀏覽量:1368

-
可重復使用醫療器械再處理說明和確認方法注冊審查指導原則(征求意見稿) 2023年11月7日,根據國家藥品監督管理局醫療器械注冊審查指導原則制修訂的有關要求,國家藥監局器審中心對《可重復使用醫療器械再處理驗證方法和標識注冊技術審查指導原則(一)》和《可重復使用醫療器械再處理說明和確認方法注冊技術審查指導原則(二)》進行了修訂完善,制定了《可重復使用醫療器械再處理說明和確認方法注冊審查指導原則(征求意見稿)》,即日起在網上再次公開征求意見。 時間:2023/11/9 20:22:23 瀏覽量:2375
-
醫療器械說明書編寫要點 醫療器械注冊人是醫療器械說明書編寫的第一責任人,需根據現行法規及指導原則的相關規定提供科學、真實、準確、規范的醫療器械基本信息,并應有詳實、可靠的研究數據作為支持依據。醫療器械說明書須全面符合《醫療器械說明書和標簽管理規定》。本文為大家介紹醫療器械說明書編寫要點。 時間:2023/11/9 0:00:00 瀏覽量:1495

-
心臟脈沖電場消融儀等6個創新醫療器械特別審查申請審查獲批 2023年11月9日,國家藥監局發布《創新醫療器械特別審查申請審查結果公示(2023年第8號》,消化內鏡手術輔助操作系統及配套用一次性使用消化內鏡手術柔性臂、心臟脈沖電場消融儀、植入式心臟收縮力調節器、一次性使用外周血管內超聲導管及血管內超聲治療設備、經導管主動脈瓣膜系統、經心尖二尖瓣腱索修復系統共六個產品創新醫療器械特別審查申請審查獲批。 時間:2023/11/9 0:00:00 瀏覽量:1600

-
醫療器械網絡銷售監管日趨完善、嚴格 2023年11月7日,國家藥監局器械監管司在京召開第二次醫療器械網絡銷售合規治理工作報告會。國家藥監局與互聯網醫療器械銷售第三方平臺的合作,將幫助實現更加完善的醫療器械網絡銷售業態監管,醫療器械網絡銷售備案監管將日趨嚴格。 時間:2023/11/8 21:35:47 瀏覽量:1275

-
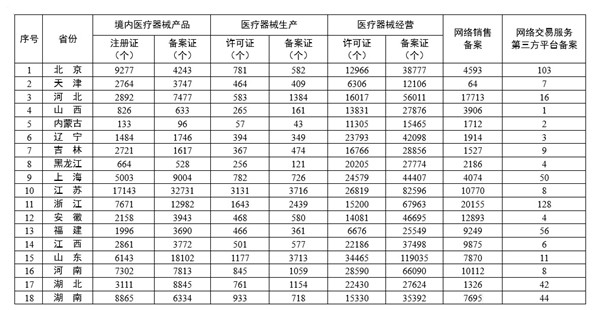
上海醫療器械注冊證數量超過5000張 根據國家藥監局公布的數據,截止2023年10月31日,上海醫療器械注冊證數量達到5003張,當然,目前排名前三的依然還是廣東、江蘇、北京,其中,廣東省醫療器械注冊證數量18580張,江蘇醫療器械注冊證數量17143張;北京醫療器械注冊證數量9277張。浙江醫療器械注冊證數量也來到了7671張。 時間:2023/11/8 21:12:58 瀏覽量:1266
-
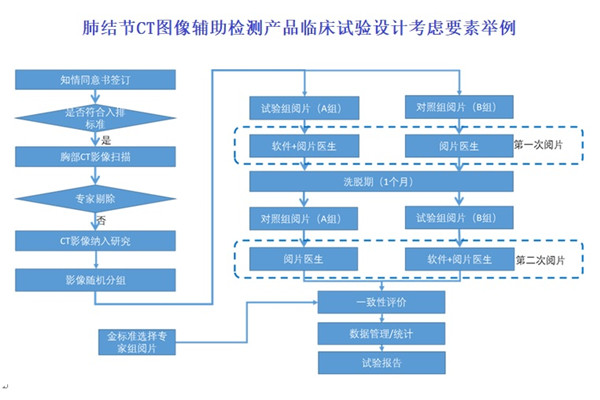
肺結節CT圖像輔助檢測產品臨床試驗設計考慮要素舉例 肺結節CT圖像輔助檢測產品臨床試驗設計考慮要素,包括臨床試驗設計類型、評價指標、樣本量估算及統計學分析。 時間:2023/11/7 18:13:03 瀏覽量:1525
-
人工智能輔助檢測醫療器械(軟件)臨床評價注冊審查指導原則 為進一步規范人工智能輔助檢測醫療器械(軟件)產品的管理,國家藥監局器審中心組織制定了《人工智能輔助檢測醫療器械(軟件)臨床評價注冊審查指導原則》(2023年第38號),并與2023年11月7日公開發布,詳見正文。 時間:2023/11/7 18:07:00 瀏覽量:1664
-
2023年10月進口第一類醫療器械產品備案信息 來自國家藥監局的數據,2023年10月國家藥監局累計批準進口第一類醫療器械產品備案事項62項,涵蓋了種植體安裝輔助器械、清洗液、口腔科手術器械、醫用冰墊、低速臺式離心機、造口袋等62個進口第一類器械醫療器械備案產品。詳見正文。 時間:2023/11/7 17:56:47 瀏覽量:1529

-
銷售呼吸機辦理醫療器械經營許可證什么要求? 呼吸機屬于近年熱門醫療器械注冊產品之一,并逐步從醫療機構走向家庭應用。考慮到呼吸機的廣泛需求,寫個小文章近期多個客戶問到銷售呼吸機辦理醫療器械經營許可證什么要求,因此,寫個小文章一并說明,順帶說說近期醫療器械經營許可證辦理要求變化。 時間:2023/11/5 22:23:24 瀏覽量:2010

-
呼吸機注冊審查指導原則(2023年修訂版) (征求意見稿) 呼吸機注冊審查指導原則(2023年修訂版)(征求意見稿)旨在指導醫療器械注冊申請人對呼吸機注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。 時間:2023/11/5 22:08:42 瀏覽量:1988

-
《藥物臨床試驗機構監督檢查辦法(試行)》將于2024年3月1日起實施 為進一步加強對藥物臨床試驗機構的管理,規范藥物臨床試驗機構監督檢查工作,國家藥監局組織制定了《藥物臨床試驗機構監督檢查辦法(試行)》,并于2023年11月3日發布。本通告自2024年3月1日起實施。 時間:2023/11/5 21:55:02 瀏覽量:2371

-
浙江省醫療器械注冊現場核查的法規依據是什么? 近期,常有浙江省醫療器械注冊企業打電話問到我,隨著2022年9月29日國家藥監局發布的《醫療器械注冊質量管理體系核查指南》(2022年第50號)的生效,浙江省醫療器械注冊現場核查的法規依據是指南,還是照舊是《醫療器械生產質量管理規范》?這確實是個需要厘清的問題。一起看正文。 時間:2023/11/3 0:00:00 瀏覽量:1248
-
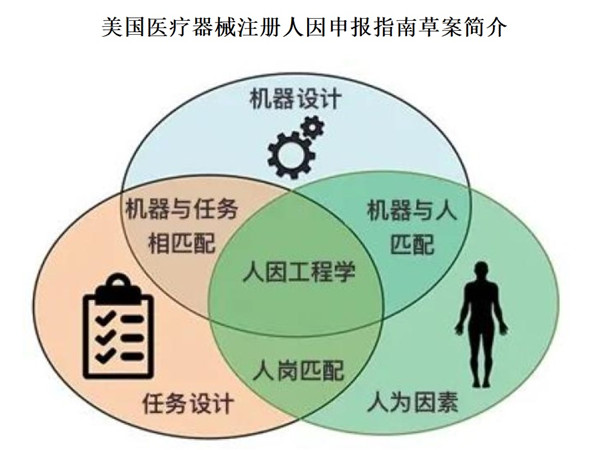
美國醫療器械人因申報指南草案簡介 人因工程是醫療器械可用性和安全性的系統工程,是醫療器械安全、有效性的基本要素之一,也是全球主要醫藥監管體日趨重視的醫療器械注冊審評要點。我國自2022年起提出的可用性工程文檔編制要求亦是人因工程的一方面。本文為大家介紹美國食品藥品監督管理局(FDA)于2022年12月公布《醫療器械人因申報指南》草案。 時間:2023/11/3 22:20:49 瀏覽量:1348
-
《醫療器械注冊質量管理體系核查指南》中對自檢有什么要求? 《醫療器械注冊質量管理體系核查指南》是現行適用的注冊質量體系核查規范文件,其中對醫療器械注冊自檢檢測事項進行了規定,一起來按具體內容。 時間:2023/11/2 15:59:43 瀏覽量:1239

