- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
水膠體敷料臨床豁免情況不包括哪些? 對于作為第二類醫療器械注冊管理的敷料類產品注冊項目,多數醫療器械注冊人對產品是否能夠豁免醫療器械臨床試驗極其關注,當然也是需要重點關注事項,因為,醫療器械臨床試驗不止是注冊服務費用的增加,還有醫療器械注冊申報周期的大幅拉長。本文為大家說說水膠體敷料臨床豁免不包括哪些情況,一起看正文。 時間:2025-7-16 20:24:02 瀏覽量:419

-
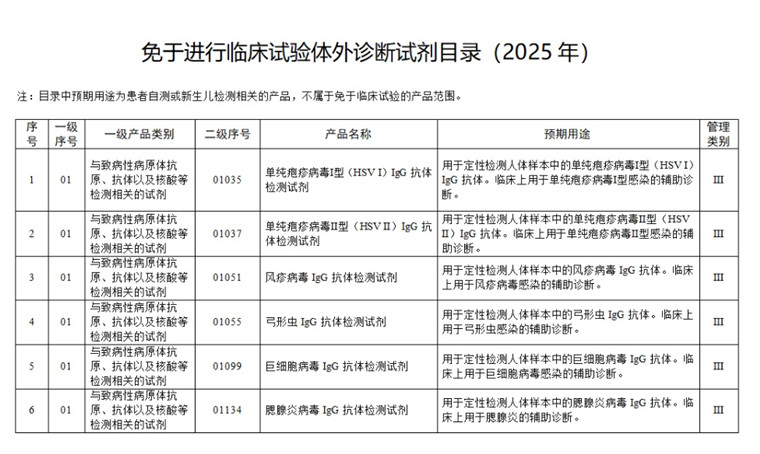
剛剛!國家藥監局發布《免于進行臨床試驗體外診斷試劑目錄(2025年)》 2025年6月24日,國家藥監局發布《關于發布免于進行臨床試驗體外診斷試劑目錄(2025年)》,體外診斷試劑注冊企業可以收藏起來,一起來看具體內容。 時間:2025-6-24 16:30:20 瀏覽量:591
-
企業間發生醫療器械項目轉讓,項目涉及的臨床試驗報告能否一并轉讓給接收企業? ?對于醫療器械注冊項目來說,存在在注冊過程中項目發生轉讓的這種情形。這種企業與企業間發生醫療器械的項目轉讓,項目涉及的臨床試驗報告能否隨項目一并轉讓給接收企業?一起看正文。 時間:2025-6-15 22:27:25 瀏覽量:570

-
醫療器械臨床試驗適應性設計技術指導原則(試行)(征求意見稿) 2025年5月23日,根據國家藥品監督管理局醫療器械注冊審查指導原則制修訂計劃的有關要求,國家藥監局起草了《醫療器械臨床試驗適應性設計技術指導原則(試行)(征求意見稿)》,并面向社會公開征求意見,一起來看具體內容。 時間:2025-5-24 22:37:50 瀏覽量:933
-
體外膜肺氧合系統臨床試驗設計要點 ?體外膜肺氧合醫療器械產品分為體外膜肺氧合設備和體外膜肺氧合器具,可通過同品種臨床評價路徑或是醫療器械臨床試驗完成臨床評價。本文為大家介紹體外膜肺氧合系統臨床試驗設計要點,一起看正文。 時間:2025-4-22 22:20:23 瀏覽量:718
-
I型膠原軟骨修復產品動物實驗設計、實驗動物模型及執行要點 ?對于I型膠原軟骨修復產品注冊項目來說,通過大動物實驗驗證產品的安全有效性,并為人體臨床試驗提供支撐,是常見做法。本文為大家介紹I型膠原軟骨修復產品動物實驗設計、實驗動物模型、受試器械、對照品和實驗動物數量、動物試驗持續時間、評價標準及動物實驗報告等事項要點,一起看正文。 時間:2025-4-21 22:55:14 瀏覽量:967

-
醫療器械臨床試驗結束后、申報注冊前增加產品規格型號,是否可以按增加后的規格型號進行注冊申報? 對于醫療器械注冊項目來說,盡可能避免摸石頭過河,走一步算一步。最好是在項目開始時,以終為始確定所需注冊的產品,規劃醫療器械注冊路徑,并前置預見風險、合理控制風險。今天有客戶問到在醫療器械臨床試驗結束后、申報注冊前增加產品規格型號,是否可以按增加后的規格型號進行注冊申報?考慮到這個問題比較典型,因此寫個文章說說這個事。 時間:2025-4-19 21:56:34 瀏覽量:734

-
透析用自體動靜脈內瘺藥物涂層球囊擴張導管臨床試驗考慮要素舉例 ?透析用自體動靜脈內瘺藥物涂層球囊擴張導管在我國屬于第三類醫療器械注冊產品,且不在免于醫療器械臨床試驗目錄之內,多數情況下,透析用自體動靜脈內瘺藥物涂層球囊擴張導管需要通過醫療器械臨床試驗路徑完成臨床評價,本文為大家介紹驗考慮要素,一起看正文。 時間:2025-3-29 20:40:34 瀏覽量:783

-
外周藥物涂層球囊擴張導管臨床試驗注冊審查指導原則(2025年第2號) 2025年3月28日,為進一步規范外周藥物涂層球囊擴張導管醫療器械的管理,國家藥監局器審中心組織制定了《外周藥物涂層球囊擴張導管臨床試驗注冊審查指導原則》,并于今日發布,一起來看具體內容。 時間:2025-3-28 20:48:49 瀏覽量:1103
-
醫療器械臨床試驗是否需針對同一注冊單元所有型號規格進行試驗? 對于醫療器械注冊檢驗,我們知道可以使用同一注冊單元的典型型號覆蓋,再對差異部分進行部分檢測。對于醫療器械臨床試驗,是否需要針對同一注冊單元所有型號規格進行試驗呢?今天一起來說說這個問題。 時間:2025-2-4 20:50:09 瀏覽量:1289
-
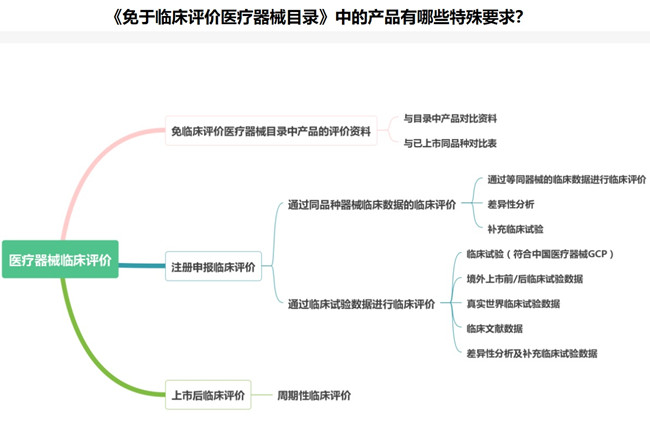
《免于臨床評價醫療器械目錄》中的產品有哪些特殊要求? 對于醫療器械臨床評價這個事項,我們知道有同品種比對臨床評價和醫療器械臨床試驗,此外,還有一類是免于醫療器械臨床試驗的產品,對于《免于臨床評價醫療器械目錄》中的這些醫療器械,部分產品同樣有醫療器械臨床驗證要求,本文為大家說說這些特殊要求。 時間:2025-1-12 20:54:31 瀏覽量:1132
-
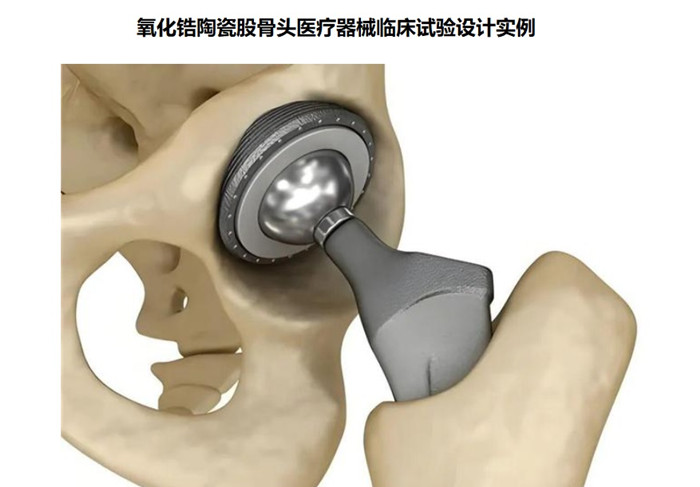
氧化鋯陶瓷股骨頭醫療器械臨床試驗設計實例 氧化鋯陶瓷股骨頭為髖關節假體組件,股骨柄部插入股骨髓腔內后, 陶瓷股骨頭與髖臼內襯、髖臼(外)杯形成旋轉關節面, 實現髖關節的運動。利用機械原理形成新的關節活動。氧化鋯陶瓷股骨頭在我國屬于第三類醫療器械注冊產品,目前,需要通過醫療器械臨床試驗完成臨床評價,本文為大家介紹氧化鋯陶瓷股骨頭醫療器械臨床試驗設計實例,一起看正文。 時間:2024-11-26 0:00:00 瀏覽量:1172
-
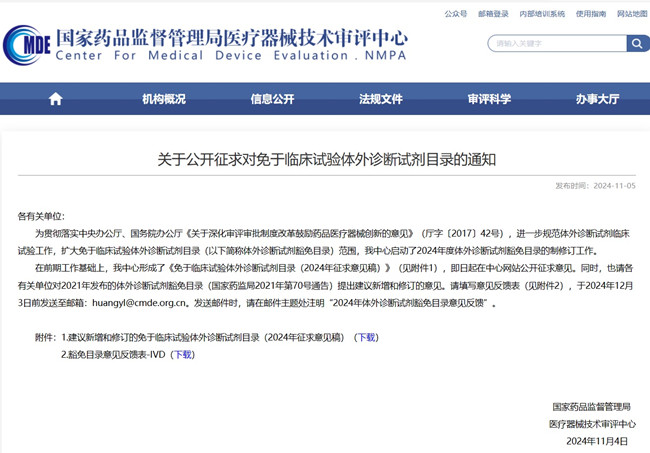
建議新增和修訂的免于臨床試驗體外診斷試劑目錄(2024年征求意見稿) 2024年11月5日,國家藥監局發布《關于公開征求對免于臨床試驗體外診斷試劑目錄的通知》,一起來看具體內容。 時間:2024-11-5 20:15:53 瀏覽量:1461
-
創新醫療器械注冊在臨床評價部分是否可以遞交同品種臨床評價報告? 關于創新醫療器械注冊產品,多數情況下,因為其具有的創新性導致在市面上很難有同類產品,而面臨醫療器械臨床試驗要求,但這并不是必然。本文為大家說說創新醫療器械注冊時在臨床評價部分是否可以遞交同品種臨床評價報告這個話題,一起看正文。 時間:2024-10-30 20:56:39 瀏覽量:1094

-
呼吸道病原體六重核酸檢測試劑盒(PCR-熒光探針法)臨床試驗設計實例 呼吸道病原體六重核酸檢測試劑盒(PCR-熒光探針法)在我國屬于第三類體外診斷試劑產品,產品用于定性檢測人咽拭子樣本中的呼吸道病原體,包括甲型流 感病毒、乙型流感病毒(Victoria 系和 Yamagata 系)、腺病毒(B 組、 C 組、E 組)、呼吸道合胞病毒(A 亞型和 B 亞型)、肺炎支原體和百日咳鮑特菌。 時間:2024-10-5 22:24:12 瀏覽量:1581

-
國家藥監局發布無源植入器械等六大類醫療器械臨床試驗設計類型推薦意見 2024年9月27日,在《醫療器械臨床評價推薦路徑》的基礎上,在無源植入器械、神經和心血管手術器械、口腔科器械、放射治療器械、醫用成像器械、醫用診察和監護器械等推薦開展臨床試驗的產品中,器審中心選取了典型產品, 按照產品名稱、結構組成和適用范圍,以舉例的方式給出具體產品臨床試驗設計類型(“隨機對照設計”或“可考慮采用單組設計”)的推薦意見。 時間:2024-9-27 0:00:00 瀏覽量:2101

-
外科用封合劑臨床前研究及臨床試驗設計要點 外科用封合劑注冊產品在我國屬于第三類醫療器械注冊產品,且不在免于醫療器械臨床試驗醫療器械目錄內,因此,醫療器械注冊人需要通過醫療器械臨床試驗或是同品種臨床評價完成臨床評價,本文為大家說說外科用封合劑臨床前研究及臨床試驗設計要點。 時間:2024-9-26 19:44:28 瀏覽量:1507

-
2024年上海市醫療器械臨床試驗機構備案后檢查情況 ?2024年3月至8月,上海市藥品監督管理局組織開展2024年上海市醫療器械臨床試驗機構備案后監督檢查和臨床試驗項目監督抽查。本次臨床試驗機構檢查內容包括機構部分和專業部分共16個環節96個檢查項目,共出動188人次,覆蓋全市43家臨床試驗機構,檢查結果為16家符合要求,27家整改后符合要求。臨床試驗項目共抽查5個,檢查內容共6個環節72個檢查項目。 時間:2024-9-24 0:00:00 瀏覽量:1318

-
可以使用醫療器械注冊證過期的同類醫療器械臨床評價資料進行臨床評價嗎? 由于醫療器械注冊證是許可類證書,有5年的有效期,不少醫療器械注冊崗位小伙伴在選擇同類可比醫療器械開展臨床評價時,發現拿到的醫療器械注冊證信息已經超過有效期,并且不清楚對比企業是否已經完成延續注冊,在此情況下,可以使用醫療器械注冊證過期的同類醫療器械臨床評價資料進行臨床評價嗎?一起看正文。 時間:2024-9-8 17:46:36 瀏覽量:1699

-
醫療器械注冊產品材料介導致熱性一般應如何評價? ?依據醫療器械生物學評價標準,部分與人體接觸的醫療器械需要進行材料介導致熱性評價,本文為大吉啊介紹醫療器械注冊產品材料介導致熱性的評價要求,一起看正文。 時間:2024-9-6 0:00:00 瀏覽量:1648

