- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
上海第二類醫療器械注冊要多少時間? 第二類醫療器械注冊需要多少時間?主要考慮幾個方面,一是企業產品研發及制造能力準備時間;二是產品注冊檢驗時間;三是醫療器械注冊審評時間;四是或有的醫療器械臨床試驗時間(針對不能豁免臨床試驗的產品)。近日,上海市發布了上月及上半年第二類醫療器械注冊審評時間,可以作為項目周期預算的參考。 時間:2021/9/12 17:50:52 瀏覽量:2776

-
天津市醫用超聲耦合劑產品備案指導原則 醫用超聲耦合劑產品屬于第一類醫療器械,需辦理第一類醫療器械產品備案,天津市醫用超聲耦合劑產品備案指導原則(試行),不止是天津,其它省市企業也可以參考。 時間:2021/9/12 17:35:31 瀏覽量:2126

-
天津市醫用冷敷貼產品備案指導原則(試行) 近幾年來,藥監總局多次發文,禁止醫用面膜相關產品的生產和宣傳。從醫療器械專業及監管機構角度,醫用冷敷貼與醫用面膜是兩回事,為更好指導企業、規范市場,天津市藥監局于2021年初發布了《天津市醫用冷敷貼產品備案指導原則(試行)》,詳見正文。 時間:2021/9/12 17:28:05 瀏覽量:2626

-
醫用冷敷貼辦理第一類醫療器械備案要求 醫用冷敷貼產品屬于第一類醫療器械,因為其良好的醫療功能,在市面上廣泛應用,我們知道,我國實行第一類醫療器械備案證管理,醫用冷敷貼備份有什么特殊要求呢? 時間:2021/9/12 17:18:45 瀏覽量:4727

-
原江蘇省食藥監局副局長被判11.5年 2021年9月8日,南京市中級人民法院公開宣判江蘇省市場監督管理局原黨組成員、副局長樊路宏受賄案,對被告人樊路宏以受賄罪判處有期徒刑十一年六個月,并處罰金人民幣一百八十萬元;對受賄犯罪所得財物及其孳息予以追繳,上繳國庫。 時間:2021/9/11 12:51:41 瀏覽量:2856

-
YY0671-2021《醫療器械睡眠呼吸暫停治療面罩和應用附件》等 63項醫療器械行業標準 ?2021年09月09日,藥監總局發布關于發布YY 0671-2021《醫療器械 睡眠呼吸暫停治療 面罩和應用附件》等63項醫療器械行業標準的公告(2021年第109號),詳見正文。 時間:2021/9/9 17:54:13 瀏覽量:4339

-
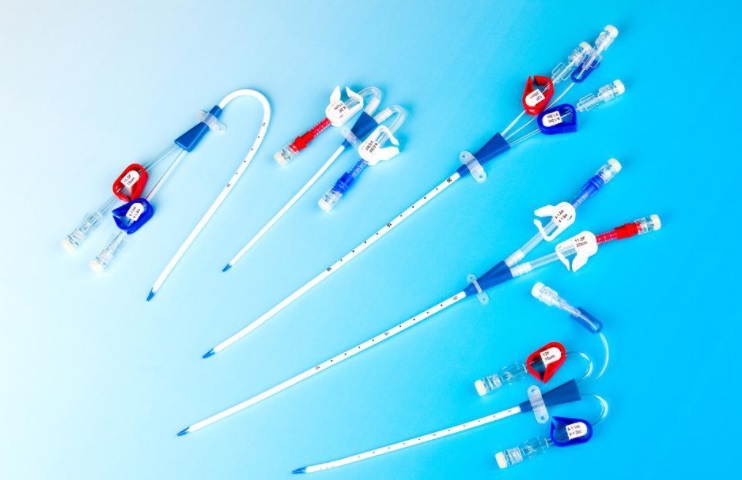
血管內導管典型產品概述 血管內導管典型產品包括中心靜脈導管(CVC)、經外周中心靜脈導管(PICC)、植入式給藥裝置(TIAP)、靜脈留置針(IV-Caths.)等等,在臨床上廣泛醫用。 時間:2021/9/9 0:00:00 瀏覽量:4630

-
血管內導管同品種對比臨床評價技術審查指導原則(2021年第68號) 2021年9月7日,為加強醫療器械產品注冊工作的監督和指導,進一步提高注冊審查質量,國家藥品監督管理局組織制定了《血管內導管同品種對比臨床評價技術審查指導原則》。 時間:2021/9/9 0:00:00 瀏覽量:2994

-
江蘇省一次性使用無菌導尿管技術審評要點 江蘇省一次性使用無菌導尿管技術審評要點 時間:2021/9/7 23:17:58 瀏覽量:2467

-
江蘇省醫療器械注冊電子申報過渡期內補正資料遞交要求 ?江蘇省醫療器械注冊電子申報過渡期內補正資料遞交要求 時間:2021/9/7 23:12:16 瀏覽量:2576

-
進口第一類醫療器械產品備案信息(2021年08月) 盡管資本市場更加看重高風險的第三類醫療器械,但也有許多經營一類醫療器械的企業取得優異經營績效。2021年08月,共計123個進口第一類醫療器械產品備案?獲批,一起來看看有哪些產品。 時間:2021/9/7 23:05:11 瀏覽量:7640

-
增材制造金屬植入物質量均一性注冊審查指導原則(征求意見稿) 2021年9月6日,為規范醫療器械注冊?產品技術審評,指導注冊申請人進行增材制造金屬植入物產品注冊申報藥監總局發布關于公開征求《增材制造金屬植入物質量均一性注冊審查指導原則(征求意見稿)》意見的通知,面向公眾公開征求意見。 時間:2021/9/6 18:57:59 瀏覽量:2160

-
湖南發布提高醫療器械注冊審評效率方案 2021年9月1日,湖南省藥品監督管理局發布關于印發《醫療器械技術審評提質增效行動方案》的通知(湘藥監發〔2021〕30號),方案致力于提升湖南省醫療器械注冊審評效率。詳見正文。 時間:2021/9/4 0:00:00 瀏覽量:2546

-
我國醫療器械法規清單(更新至2021年9月) ?我國醫療器械法規清單(更新至2021年9月) 時間:2021/9/3 20:13:06 瀏覽量:11116

-
2021年9月起實施的醫療器械標準清單 對于醫療器械生產企業或是醫療器械注冊項目來說,醫療器械行業標準變化是必須關注的內容,本文為您羅列了2021年9月1日起開始實施的醫療器械標準清單,建議收藏哦。 時間:2021/9/3 20:06:33 瀏覽量:4013

-
浙江省第二類醫療器械注冊指定檢驗辦理流程和常見問題 信息系統在行政審批業務中的廣泛應用,要求企業相關人員要熟悉政府審批系統及了解信息系統的變化。就醫療器械注冊事項而言,浙江省第二類醫療器械注冊指定檢驗辦理因為涉及到兩個平臺,流程是較為復雜。 時間:2021/9/2 12:46:16 瀏覽量:2729

-
血液透析用耗材中鋁離子的危害與一般對策 很多血液相關第三類醫療器械注冊產品,血液透析用耗材如血液透析管路、血液透析器、血液透析濃縮物(液或干粉)等。隨著醫療技術水平的不斷發展,血液透析患者長期生存現象比較普遍,目前對透析治療產品中重金屬超標可能引起的合并癥缺乏相應研究,如鋁、鉛、砷等,在維持性血液透析治療患者接觸透析耗材的頻率一般為2~3次/周。血液透析用中心靜脈導管中的鋁離子總量超標,長期應用后導致的鋁性腦病。 時間:2021/9/1 18:29:29 瀏覽量:3865
-
應用納米材料的醫療器械安全性和有效性評價指導原則第一部分:體系框架 2021年8月26日,為加強醫療器械產品注冊工作的監督和指導,進一步提高醫療器械注冊審查質量,國家藥品監督管理局組織制定了《應用納米材料的醫療器械安全性和有效性評價指導原則第一部分:體系框架》,詳見正文。 時間:2021/9/1 18:20:15 瀏覽量:3921

-
總局發布醫療器械延續注冊答疑1項 已注冊產品未在規定時間內申請延續注冊,申請產品注冊時,臨床評價可否選擇原注冊產品作為同品種產品完成臨床評價?臨床數據應如何提供? 時間:2021/8/31 19:08:29 瀏覽量:1884

-
體外診斷試劑臨床試驗時關于樣本應注意什么問題 體外診斷試劑臨床試驗時關于樣本應注意什么問題 時間:2021/8/31 19:04:04 瀏覽量:2161

