- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
江浙滬地區YYT9706.106-2021可用性工程文檔編制服務機構 杭州證標客醫藥技術咨詢有限公司是國內最早開展可用性工程文檔相關法規研究的機構之一,是最早推出YYT9706.106-2021可用性工程文檔編制服務機構之一,為江浙滬地區客戶提供優質、專業的可用性工程文檔編制服務。 時間:2023-6-3 0:00:00 瀏覽量:3787

-
越南醫療器械注冊流程和要求 越南因為毗鄰我國這樣的大國,所以,大家都覺得越南是個小國,但事實上,越南擁有接近33萬平安方公立國土面積和接近1億的人口。醫療器械產業與人口數量正相關,因此,寫個文章為大家科普越南醫療器械注冊流程和要求。 時間:2023-6-2 17:51:50 瀏覽量:3504

-
醫療器械經營質量管理規范(修訂草案征求意見稿) 2023年6月1日,為貫徹落實《醫療器械監督管理條例》《醫療器械經營監督管理辦法》,國家藥監局組織起草了《醫療器械經營質量管理規范(修訂草案征求意見稿)》,并向社會公開征求意見。 時間:2023-6-2 11:07:33 瀏覽量:2655

-
人工智能醫療器械注冊監管概況 作為醫療器械行業從業者,多年工作經歷讓我習慣看風險多于收益。對于人工智能的應用,我還是挺擔心看到人工智能在使用人工智能的那一天。對于人工智能醫療器械注冊產品,在很多方面幫助到臨床和科研,但仍然需要監管。本文帶大家一起關注人工智能醫療器械注冊監管概況。 時間:2023-6-1 18:46:17 瀏覽量:1840

-
醫療器械注冊質量管理體系之軟件確認應包含哪些軟件? IT技術在醫療行業的應用是醫療行業的大機遇,并日益成為常態。對于醫療器械注冊質量管理體系來說,要求對醫用器械質量管理體系相關軟件進行確認,但是YY/T0287、ISO13485及醫療器械GMP法規文件對軟件確認范圍表述比較簡略,多數企業都不清楚軟件確認的范圍和要求。那醫療器械軟件確認的范圍通常包括哪些呢?一起看正文。 時間:2023-6-1 18:34:51 瀏覽量:2064

-
醫療器械注冊體系核查要求之設計開發審查重點 相比于ISO9001設計開發管理來說,醫療器械注冊質量管理體系對設計開發的要求多了一層,即除產品設計開發之外,還需要考慮制程設計開發事項。設計開發既有產品功能性能的實現,亦有量產對人機料法環的要求。 時間:2023-5-30 17:52:35 瀏覽量:2035

-
血管介入器械表面潤滑涂層風險評估及監管探索 20 世紀 80 年代中期以來,在介入心臟病學、介入神經放射學及介入血管外科領域,廣泛利用聚合物作為血管內導管/導絲等器械的潤滑涂層,其目的為增強該類介入器械表面的潤滑性及其在血管內的通過性。潤滑涂層包括親水性聚合物如聚乙烯吡咯烷酮、聚丙烯酸以及疏水性聚合物如聚四氟乙烯等,可以有效減少介入器械表面摩擦,降低血管壁損傷風險,并防止血管痙攣及血栓形成。 時間:2023-5-30 17:39:07 瀏覽量:1462

-
重組人源化膠原蛋白原材料評價指導原則(2023年第16號) 近日,國家藥監局發布《重組人源化膠原蛋白原材料評價指導原則(2023年第16號)》,本指導原則旨在指導醫療器械注冊?申請人對醫療器械所用重組人源化膠原蛋白原材料進行充分的研究,并整理形成產品注冊申報資料,同時也為技術審評部門對重組人源化膠原蛋白制成的產品注冊申報資料包括所引用主文檔相關內容的技術審評提供參考。 時間:2023-5-27 20:22:03 瀏覽量:2514
-
重組膠原蛋白創面敷料注冊審查要點 重組膠原蛋白創面敷料注冊產品在醫美市場廣受歡迎,考慮到醫美類醫療器械是近年藥監重點監管類別,本文為大家說說重組膠原蛋白創面敷料注冊審查要點,建議醫療器械注冊申請人收藏。 時間:2023-5-27 20:12:52 瀏覽量:1667

-
膝關節假體系統等四個產品通過創新醫療器械特別審查 2023年5月26日,國家藥監局發布《創新醫療器械特別審查申請審查結果公示(2023年第4號)》,膝關節假體系統、膝關節假體系統、混合閉環胰島素輸注系統、經導管主動脈瓣系統四個產品的創新醫療器械申請通過審批。 時間:2023-5-27 19:51:26 瀏覽量:1368

-
醫療器械注冊質量管理體系核查對人員的要求 人是組織的根本,是醫療器械注冊質量管理體系中最重要的要素。對于醫療器械注冊質量管理體缺陷來說,多數缺陷項的根本原因也是歸結到人這個要素。本文從合規的角度,說說醫療器械注冊質量管理體系核查對人員的要求。 時間:2023-5-26 12:51:25 瀏覽量:1961

-
醫療器械注冊質量管理體系核查要點之質量管理體系原則 對于醫療器械注冊質量管理體系考核來說,大家關注的更多是醫療器械GMP的要求,更多是法規符合性。但是,對于熟知質量工程的質量管理專業從業者來說,還需要掌握、理解和落地質量管理體系原則和質量管理原則。質量管理原則是質量管理體系底層邏輯的重要組成,是企業導入、維持、持續有效運行醫療器械質量管理體系的基礎。 時間:2023-5-26 12:41:37 瀏覽量:1494

-
嘉興市第一類醫療器械產品備案在哪里辦理 浙江省醫療地址第一類醫療器械產品備案都鏈接到了浙江政務服務網,但嘉興市是唯一例外未鏈接到浙江政務服務網,正好有客戶問到嘉興第一類醫療器械產品備案在哪里申請辦理,一起看本文。 時間:2023-5-25 10:31:49 瀏覽量:1337

-
獸藥經營許可證辦理流程、時間和要求 隨著寵物市場的高速發展,近幾年越來越多的客戶問到寵物藥品如何辦理經營資質及網絡銷售資質,本文以杭州市獸藥經營許可證辦理要求為例,為大家介紹獸藥經營許可證辦理流程、時間和要求。 時間:2023-5-23 14:45:39 瀏覽量:4512

-
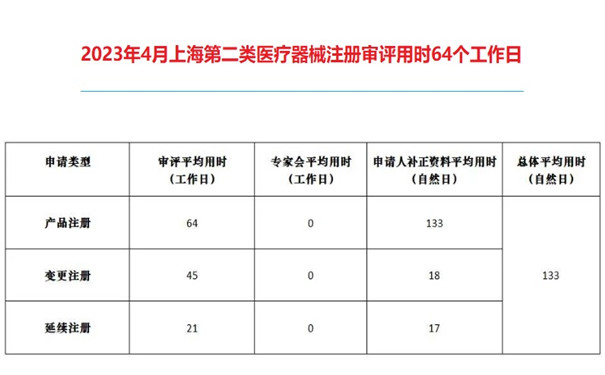
2023年4月上海第二類醫療器械注冊審評用時64個工作日 近日,上海市藥監局發布公告,2023年4月,上海第二類醫療器械注冊審評用時64個工作日,醫療器械注冊人補正資料平均用時133個自然日;上海第二類醫療器械變更注冊審評平均用時45個工作日,申請人補正資料平均用時18個自然日;上市第二類醫療器械延續注冊審評平均用時21個工作日,申請人補正資料平均用時17個自然日。 時間:2023-5-23 14:19:02 瀏覽量:1505
-
醫療器械分類目錄調整后,既往醫療器械分類界定結果還有效嗎? 我們置身的世界,多數要素都在快速變化,應對變化的能力,是我當前認知里,最難得、最需要智慧的能力。今天繼續來說一個有關變化的話題,說說醫療器械分類目錄調整后,既往醫療器械分類界定結果是否還有效。 時間:2023-5-21 19:36:07 瀏覽量:1999

-
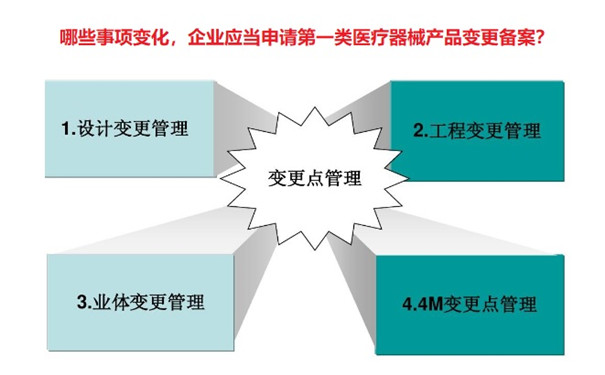
哪些事項變化,企業應當申請第一類醫療器械產品變更備案? 之前介紹醫療器械變更注冊流程和要求的文章寫得比較多,很少說第一類醫療器械備案產品如果有變更如何處理。恰好上周有多年的老客戶問到這個話題,因此決定寫個文章,說說哪些事項變化,企業應當申請第一類醫療器械產品變更備案?一起看正文。 時間:2023-5-21 19:20:29 瀏覽量:1387
-
2023年4月國家藥監局批準三類及進口醫療器械注冊產品180個 2023年5月18日,國家藥監局發布公告,2023年4月,國家藥監局共批準醫療器械注冊產品180個。其中,境內第三類醫療器械注冊產品125個,第三類進口醫療器械注冊產品21個,第二類進口醫療器械注冊產品33個,港澳臺醫療器械產品1個。 時間:2023-5-19 21:51:59 瀏覽量:4565

-
境內批準醫療器械注冊證數量達到104540個(截至2023年4月30日) 2023年5月17日,國家藥監局發布各省(自治區、直轄市)有效期內醫療器械產品注冊備案、醫療器械生產企業許可備案、醫療器械經營企業許可備案、醫療器械網絡銷售備案、醫療器械網絡交易服務第三方平臺備案信息,其中全國總計批準境內醫療器械注冊證104540個,醫療器械生產許可證19204個。 時間:2023-5-19 21:41:20 瀏覽量:2053

-
有源醫療器械注冊檢驗EMC檢驗新標準YY9706.102-2021 對于有源醫療器械注冊檢驗來說,醫療器械注冊人務必注意,自2023年5月1日起,EMC檢驗新標準YY9706.102-2021《醫用電氣設備 第1-2部分:基本安全和基本性能的通用要求 并列標準:電磁兼容要求》,不再指YY0505標準。在醫療器械注冊檢驗申請表中,檢驗依據應填寫新標準,檢驗項目處應填寫全項目。 時間:2023-5-17 0:00:00 瀏覽量:3627

