- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
手術器械類產品什么情況可以豁免生物學試驗? 對于醫療器械注冊?產品來說,是否與人體接觸的器械都需要開展生物學試驗?有無例外情況?一起來了解。 時間:2022-10-26 22:02:56 瀏覽量:1778

-
醫療器械注冊產品中的軟件委托研發,是否需要建立軟件研發全套文件? 對于多數有源醫療器械注冊產品來說,產品本身功能和性能往往都離不開軟件的作用。有源醫療器械注冊企業生產的醫療器械,其中軟件組件時委托其他公司研發的,醫療注冊人還需要建立軟件相關的全部質量體系嗎? 時間:2022-10-24 16:12:29 瀏覽量:1711

-
新版GB9706生效后是否強制要求進行醫療器械變更注冊? GB9706.1-2020新版標準生效后,對于有源醫療器械注冊企業來說,是否需要申請醫療器械變更注冊?一起來關注。 時間:2022-10-24 16:03:29 瀏覽量:1996

-
超聲軟組織手術設備注冊審查指導原則(修訂版)(征求意見稿) 超聲軟組織手術設備注冊審查指導原則(修訂版)(征求意見稿)旨在指導醫療器械注冊申請人規范超聲軟組織手術設備注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。本指導原則是對超聲軟組織手術設備的一般要求,申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-24 15:42:45 瀏覽量:1809

-
嘉興海鹽縣開展彩色隱形眼鏡生產經營專項整治行動 彩色隱形眼鏡屬于第三類醫療器械,生產企業必須取得第三類醫療器械注冊證及醫療器械生產許可證,經營企業必須取得第三類醫療器械經營許可證。近日,嘉興海鹽縣組織開展為期三個月(9-12月)的彩色隱形眼鏡生產經營專項整治行動。 時間:2022-10-22 15:05:06 瀏覽量:1802

-
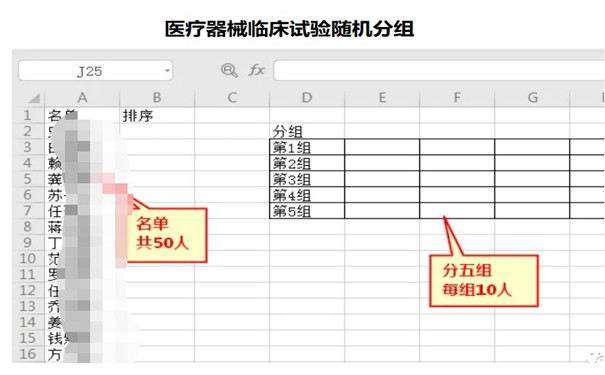
醫療器械臨床試驗隨機簡介 對于醫療器械臨床試驗設計來說,設計者對隨機理論的理解,及隨機技術的運用可能會是決定試驗成敗,影響臨床試驗質量的關鍵要素之一。合理的設計,將幫助更好的控制混雜因素和偏倚,增加樣本的可比性。 時間:2022-10-22 14:17:51 瀏覽量:1971
-
上月國家局累計批準進口第一類醫療器械備案246項 國家藥監局公布數據,2022年9月,國家藥監局累計批準進口第一類醫療器械備案246項,批準數量創年內新高。制造商既有來自歐洲、美國、日本醫療器械主要生產地,亦有來自臺灣、馬來西亞等區域產品。 時間:2022-10-21 12:49:47 瀏覽量:3827

-
各省醫療器械許可備案相關信息(截至2022年9月30日) 截止2022年9月30日,國家藥監局累計批準醫療器械注冊證97879項,醫療器械備案證131951項,其中,江蘇、廣東、北京、湖南、浙江醫療器械注冊證數量分列前五位。此外,值得注意的是,湖南醫療器械注冊證數量已達到7455個,河南醫療器械注冊已達到6174個,自2020年期,兩地醫療器械注冊證數量大幅、快速增加。 時間:2022-10-21 12:39:25 瀏覽量:1699

-
江蘇省彩色隱形眼鏡生產企業清單(獲醫療器械注冊證企業) 彩色隱形眼鏡兼具功能性和美學功能,日趨受年輕群體青睞,江蘇省是彩色隱形眼鏡生產企業較多區域,截至2022年9月30日,國家藥監局已批準我省11個生產企業共49個軟性親水接觸鏡產品上市,詳見江蘇省彩色隱形眼鏡生產企業清單(獲醫療器械注冊證企業)。 時間:2022-10-19 12:20:39 瀏覽量:3458

-
無菌醫療器械注冊產品的滅菌有什么要求? 對于無菌醫療器械注冊產品來說,常見滅菌方式包括環氧乙烷滅菌、輻照滅菌、濕熱蒸汽滅菌等方式,本文來說說無菌醫療器械注冊產品的滅菌要求。 時間:2022-10-17 0:00:00 瀏覽量:1700

-
選擇和使用隱形眼鏡需注意事項 之前科普了許多有關醫療器械經營許可及合規相關問題,本文從使用者角度,說一說選擇和使用隱形眼鏡需注意事項。 時間:2022-10-17 0:00:00 瀏覽量:1958

-
藥監總局受理前醫療器械注冊咨詢工作安排調整 2022年10月16日,器審中心發布《關于醫療器械受理前技術問題咨詢工作安排調整的通告(2022年第37號)》,藥監總局受理前醫療器械注冊咨詢工作安排調整,將四川省醫療器械創新服務站、吉林省醫療器械創新服務站、福建省醫療器械創新服務站、北京市藥品監督管理局、海南省藥品監督管理局做為參與單位納入注冊受理前技術問題咨詢工作范圍。 時間:2022-10-17 0:00:00 瀏覽量:1883

-
高流量呼吸治療儀注冊審查指導原則(征求意見稿) 高流量呼吸治療儀注冊審查指導原則(征求意見稿)旨在指導醫療器械注冊申請人對高流量呼吸治療設備注冊申報資料的準備及撰寫,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對高流量呼吸治療設備注冊的一般要求,申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-14 13:11:05 瀏覽量:1786

-
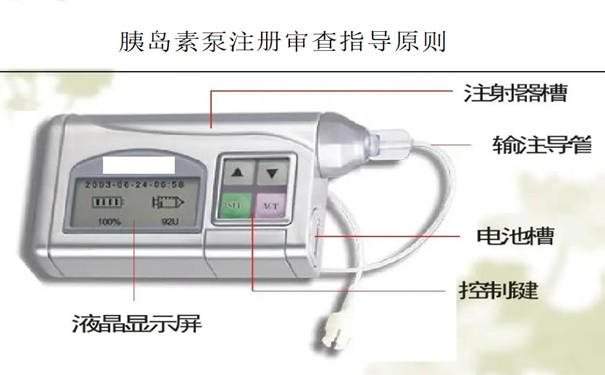
胰島素泵注冊審查指導原則(征求意見稿) 《胰島素泵注冊審查指導原則(征求意見稿)》旨在指導醫療器械注冊申請人對胰島素泵注冊申報資料的準備及撰寫,同時也為技術審評部門審查注冊申報資料提供參考。本指導原則是對胰島素泵注冊的一般要求,申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-14 13:02:38 瀏覽量:2186
-
從仿制到創新,創新醫療器械注冊審批之路越走越平坦 盡管新中國醫療器械有序監管之路起步相對較晚,但從第一個醫療器械監管法規制定之日起,領導層就高瞻遠矚、逐步為創新醫療器械注冊審評建立秩序,鋪平道路。自2014年2月,國家藥監部門發布《創新醫療器械特別審批程序(試行)》,不斷為創新醫療器械注冊審評出臺專項制度,有序推進醫療器械產業創新發展。僅2022年初至今,我國獲批上市的創新醫療器械就達到44個,這一數字早已超過了2021年全年的數字。 時間:2022-10-14 12:28:55 瀏覽量:1604

-
銷售寨卡病毒核酸檢測試劑需要辦理什么證? 寨卡病毒最早于1947年偶然通過黃熱病監測網絡在烏干達寨卡叢林的恒河猴中發現,隨后于1952年在烏干達和坦桑尼亞人群中發現,并在境外呈現散發狀態,我國亦有不少企業持續在未寨卡病毒防控作出貢獻,盡管多數面向境外市場,但是,企業仍然要關注寨卡病毒在國內的流通,知悉銷售寨卡病毒核酸檢測試劑需要辦理什么證? 時間:2022-10-12 9:46:31 瀏覽量:1667

-
寨卡病毒核酸檢測試劑注冊審查指導原則(征求意見稿) 寨卡病毒核酸檢測試劑注冊審查指導原則(征求意見稿)旨在指導注冊申請人對寨卡病毒核酸檢測試劑注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對寨卡病毒核酸檢測試劑的一般要求,體外診斷試劑注冊申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-12 9:28:21 瀏覽量:1475

-
一次性使用靜脈營養輸液袋注冊審查指導原則(征求意見稿) 一次性使用靜脈營養輸液袋注冊審查指導原則(征求意見稿)旨在指導醫療器械注冊申請人對一次性使用靜脈營養輸液袋(以下簡稱“靜脈營養袋”)注冊申報資料的準備及撰寫,同時也為技術審評部門對注冊申報資料的審評提供參考。 時間:2022-10-12 9:17:28 瀏覽量:1591

-
牙科粘接劑產品注冊審查指導原則(征求意見稿) 2022年10月10日為規范產品技術審評,指導醫療器械注冊申請人進行牙科粘接劑產品注冊申報,藥監總局起草了《牙科粘接劑產品注冊審查指導原則(征求意見稿)》,現向社會公開征求意見。 時間:2022-10-10 10:50:19 瀏覽量:1887

-
11月起,藥監總局發放藥品電子注冊證 2022年10月09日,國家藥監局發布《關于發放藥品電子注冊證的公告(2022年 第83號)》,自2022年11月1日起,發放藥品電子注冊證。 時間:2022-10-10 10:40:12 瀏覽量:2048

