- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
采用有醫療器械注冊證的牙科膜片制造隱形矯治器應考慮哪些內容? 按照我國醫療器械注冊管理機制,當前多數醫療器械注冊產品要求必須是具有獨立醫療功能的成品,但也有例外,比如口腔器械大類里面,有氧化鋯陶瓷體和牙科膜片這兩個屬于醫療器械產品的主材,需要按照醫療器械注冊管理。本文為大姐介紹采用有醫療器械注冊證的牙科膜片制造定制式無托槽矯治器應考慮哪些內容?一起看正文。 時間:2023-7-23 18:42:28 瀏覽量:1297

-
浙江省藥監局關于提交醫療器械注冊自檢報告的注冊申報資料要求 盡管國家藥監局發布了《醫療器械注冊自檢管理規定》,并自2021年10月21日起施行;盡管醫療器械注冊自檢的底層邏輯如同照鏡子一樣簡單。但事實上,醫療器械行業的特殊性,讓醫療器械注冊自檢需要滿足許多條件和要求。本文為大家介紹浙江省藥監局關于提交醫療器械注冊自檢報告的注冊申報資料要求。 時間:2023-7-23 18:33:03 瀏覽量:1484

-
云南第二類醫療器械注冊流程、時間和申報資料要求 《醫療器械注冊與備案管理辦法》(國家市場監督管理總局令第47號)第八條:第一類醫療器械實行備案管理,第二類、第三類醫療器械實行注冊管理。境內第二類醫療器械由省、自治區、直轄市食品藥品監督管理部門審查,批準后發給醫療器械注冊證。本文為大家介紹云南第二類醫療器械注冊流程、時間和申報資料要求。 時間:2023-7-21 8:54:52 瀏覽量:2007
-
2023年第二季度上海藥監督局共批準醫療器械注冊產品93項 2023年7月18日,上海市藥監局發布《關于批準注冊93項醫療器械產品的通告》,2023年第二季度,上海市藥品監督管理局共批準首次醫療器械注冊產品93項,一起看有哪些新獲批上海醫療器械注冊產品。 時間:2023-7-19 20:02:50 瀏覽量:2100

-
上海藥監明日起提供醫療器械注冊審評補正資料預審查服務 來自上海市藥品監督管理局官方消息,明日(2023年7月20日)起,上海藥品監督管理局上海市醫療器械化妝品審評核查中心將對第二類醫療器械首次注冊申請提供補正資料預審查服務,這將進一步提高上海醫療器械注冊補正資料質量和審評工作效率,暢通對外溝通交流渠道。讓我們一起為上海市藥品監督管理局點贊。 時間:2023-7-19 19:36:35 瀏覽量:1586
-
非血管自擴張金屬支架系統注冊審查指導原則(2023年第25號) 2023年7月18日,國家藥監局發布《非血管自擴張金屬支架系統注冊審查指導原則(2023年第25號)》,本指導原則旨在指導醫療器械注冊?申請人對非血管自擴張金屬支架系統注冊申報資料的準備及撰寫,同時也為技術審評部門對非血管自擴張金屬支架系統注冊申報資料的技術審評提供參考。詳見正文。 時間:2023-7-18 0:00:00 瀏覽量:1519

-
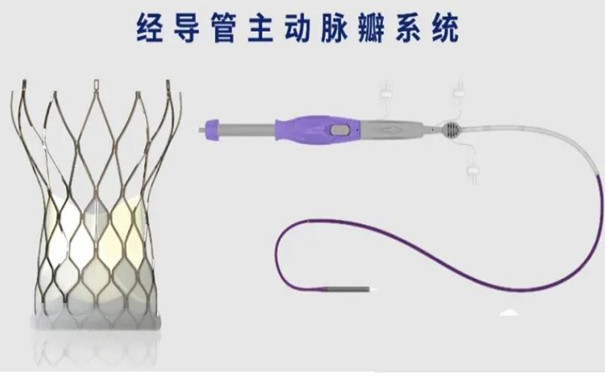
經導管主動脈瓣膜系統注冊審查指導原則(2023年第25號) 2023年7月18日,國家藥監局發布《經導管主動脈瓣膜系統注冊審查指導原則(2023年第25號)》,本指導原則旨在指導醫療器械注冊申請人對經導管主動脈瓣膜系統注冊申報資料的準備及撰寫,同時也為技術審評部門對經導管主動脈瓣膜系統注冊申報資料的技術審評提供參考。 時間:2023-7-18 0:00:00 瀏覽量:1500
-
關于醫療器械注冊證平移要求的“同一集團”怎么界定? 2023年7月14日,浙江省藥監局發布《關于簡化省外已上市第二類醫療器械遷入我省注冊申報指南(試行)》。早在2022年下半年,多地發布了有關第二類醫療器械注冊證平移相關辦法,無一例外的都提到一個詞——“同一集團”,什么是同一集團?一起看正文。 時間:2023-7-15 14:05:17 瀏覽量:1860

-
第二類醫療器械注冊證平移到浙江應具備的條件 第二類醫療器械注冊證平移到浙江應具備的條件 時間:2023-7-15 0:00:00 瀏覽量:1513

-
近日,十個醫療器械注冊產品進入國家局特別審批通道 7月11日,9個產品通過創新醫療器械特別審查申請;7月12日,1個產品計入醫療器械優先審批通道。 時間:2023-7-13 13:58:55 瀏覽量:1536

-
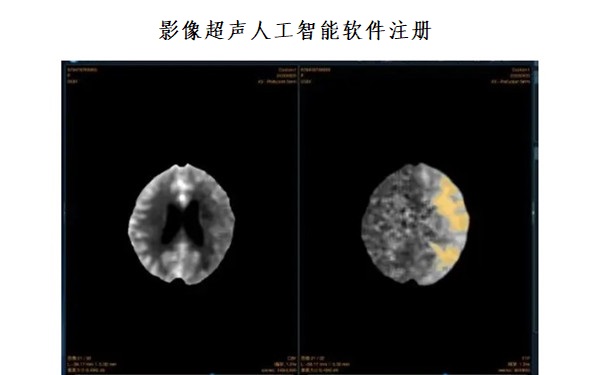
影像超聲人工智能軟件(流程優化類功能)技術審評要點(2023年第23號) 《影像超聲人工智能軟件(流程優化類功能)技術審評要點》旨在指導注冊申請人對影像超聲產品中流程優化類人工智能軟件功能注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。是對影像超聲產品中流程優化類人工智能軟件功能的一般要求,醫療器械注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2023-7-10 0:00:00 瀏覽量:1746
-
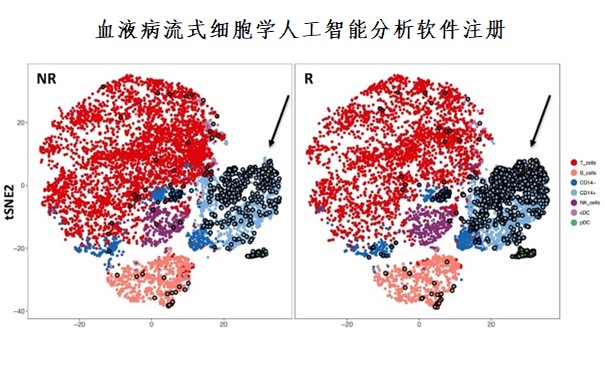
血液病流式細胞學人工智能分析軟件性能評價審評要點(2023年第23號) 《血液病流式細胞學人工智能分析軟件性能評價審評要點》旨在指導醫療器械注冊申請人對血液病流式細胞學人工智能分析軟件注冊申報資料中非臨床評價部分的準備及撰寫,同時也為技術審評部門提供參考。本要點是對血液病流式細胞學人工智能分析軟件申報資料的一般要求,申請人需依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2023-7-10 0:00:00 瀏覽量:1333
-
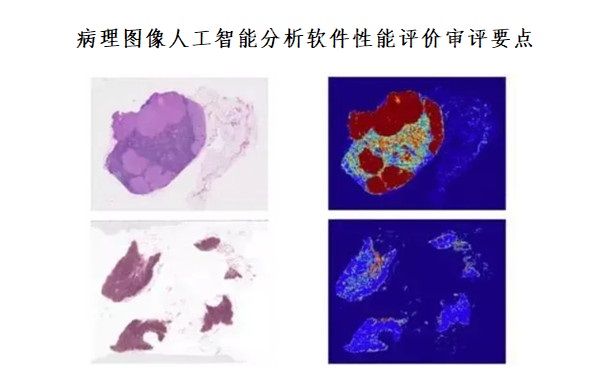
病理圖像人工智能分析軟件性能評價審評要點(2023年第23號) 病理圖像人工智能分析軟件性能評價審評要點(2023年第23號)旨在指導醫療器械注冊申請人對病理圖像人工智能分析軟件注冊申報資料中非臨床評價部分的準備及撰寫,同時也為技術審評部門提供參考。本要點是對病理圖像人工智能分析軟件申報資料的一般要求,申請人需依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對醫療器械注冊申報資料的內容進行充實和細化。 時間:2023-7-10 0:00:00 瀏覽量:2132
-
膀胱超聲掃描儀注冊費用、流程和要求 采用三維超聲容積測量技術用于測量膀胱內尿量的膀胱超聲掃描儀,廣泛應用與臨床檢測,根據《醫療器械分類目錄》,膀胱超聲掃描儀在我國屬于第二類醫療器械注冊產品,分類編碼為06-07-01。本文帶大家了解膀胱超聲掃描儀注冊費用、流程和要求。 時間:2023-7-9 11:08:53 瀏覽量:1410

-
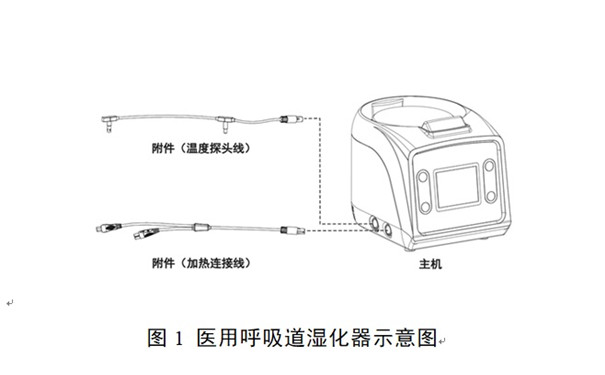
醫用呼吸道濕化器注冊流程、時間和審評要點 醫用呼吸道濕化器一般由主機、貯水箱和一些附件組成,是用于濕化輸送給患者的呼吸氣體的醫用電氣設備,通常與呼吸治療設備配合使用。按照我國醫療器械分類規則,醫用呼吸道濕化器產品屬于第二類醫療器械注冊產品,分類編碼為08-05-02。 時間:2023-7-9 10:48:37 瀏覽量:1450
-
行業預測:醫療器械注冊證轉讓流通或迎來機會 從法規層面,我國暫無醫療器械注冊證轉讓流通相關制度,因為醫療行業對社會穩定、人民福祉的重要性,醫療器械注冊證的許可和管理相對嚴格,但從本質上講,醫療器械注冊證是所有權證,是知識產權證。我個人做個預測,在不久的將來,醫療器械注冊證轉讓流通或迎來機會。 時間:2023-7-9 10:30:13 瀏覽量:1520
-
第二類創新醫療器械注冊(液囊腸梗阻導管)流程和要點 近日,浙江省藥監局發布了創新醫療器械注冊產品——液囊腸梗阻導管技術審評報告,我個人特別關注創新醫療器械產品,一方面通過創新醫療器械可以關注產業前沿,另一方面,也可以看醫療器械注冊審評尺度和風向。一起來看看液囊腸梗阻導管注冊流程、要求和相關審評要點。 時間:2023-7-7 10:42:52 瀏覽量:1721

-
馬來西亞醫療器械注冊(MDA)簡介 按照馬來西亞《醫療器械管理法》規定,所有在馬來西亞生產、進口的醫療器械產品都必須在醫療器械管理局進行醫療器械注冊后方可進入市場。對于進口的醫療器械生產商而言,需找到授權代理(authorized represetative,AR)完成注冊事宜。馬來西亞醫療器械監管的主管部門為衛生部下屬的醫療器械管理局(Medical Device Athority,MDA)。 時間:2023-7-6 0:00:00 瀏覽量:2195

-
銷售角膜接觸鏡在義烏辦理醫療器械經營許可證有什么要求? 說到醫療器械銷售,必須要說說義烏,本文為大家介紹角膜接觸鏡這個廣受年輕愛美人士青睞的第三類醫療器械產品,在義烏辦理醫療器械經營許可證的相關要求。 時間:2023-7-5 0:00:00 瀏覽量:1385

-
杭州第一類醫療器械備案時,說明書中性能指標有何要求? 對于醫療器械行業整體來說,第一類醫療器械扮演了重要角色,并在臨床上廣泛應用。考慮到新法規對第一類醫療器械備案要求有大的變化,因此,寫個文章,說說杭州第一類醫療器械備案時,說明書中性能指標表述要求。 時間:2023-7-5 16:51:59 瀏覽量:1275

