引言:MDD指令將于2021年失效,對于擬申請醫療器械CE認證的企業來說,取而代之的是面對MDR的要求,本文為您科普什么是MDR。

醫療器械CE認證之MDR簡介:
CE為法文CONFORMITE EUROPEENNE的首字母縮寫,表示“歐洲統一”。
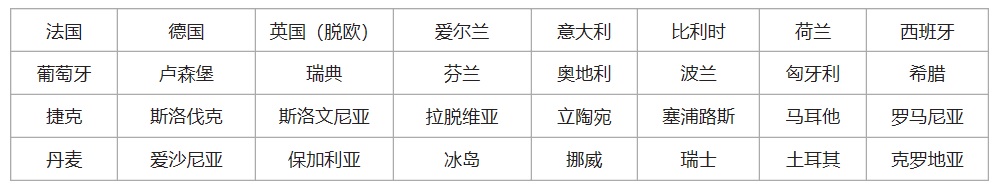
歐盟EU+歐洲自由貿易聯盟會員國,英國脫歐后,共有31個國家。
很多除歐盟外的國家,除美國FDA、日本PAL、澳大利亞TGA等,絕大數通行歐洲頒發的自由銷售證書CFS。
CE標志是一種安全認證標志,凡貼有CE標志的產品均可在歐盟各成員國內銷售,無須符合各個成員國的要求。使用CE標志,實現了商品在歐盟成員國范圍內的自由流通,因此CE標志被視為制造商打開并進入歐洲市場的通行證。
在歐盟市場“CE”標志屬強制性認證標志,不論是歐盟內部企業生產的產品,還是其他國家生產的產品,要想在歐盟市場上自由流通,就必須加貼“CE”標志,以表明產品符合歐盟《技術協調與標準化新方法》法規的基本要求, 加貼“CE”標志必須識別很多協調標準,這是歐盟法律對產品提出的一種強制性要求。
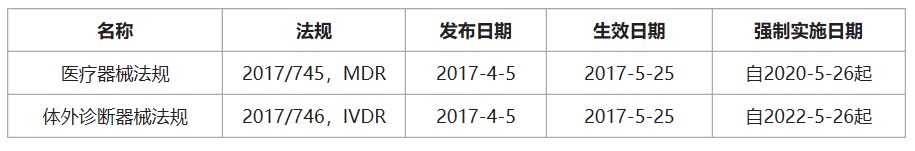
歐盟在2017年4月發布了醫療器械法規(EU)2017/745(MDR),將取代現有的醫療器械指令(MDD)93/42/EEC,自2017年5月25日起生效,醫療器械企業有3年的過渡期(即強制實施日期2020年5月26日)。MDR與MDD存在明顯差異。除了其內容多了3倍之外,主要差異包括:包括了有源植入性器械和范圍擴大至包含具有美學或非醫療目的但在功能和風險特征方面類似于醫療器械的產品。對于使用納米材料口服產品的器械有新的分類規則和符合性審核要求。
在本次發布的醫療器械法規(EU)從原先的Directive(指令)上升為Regulation(法規),標志著歐盟當局對醫療設備領域監管的進一步重視,同時也預示著在歐盟各成員國內醫療器械監管的尺度將得到進一步的統一。
醫療器械CE認證之歐盟醫療器械法規:
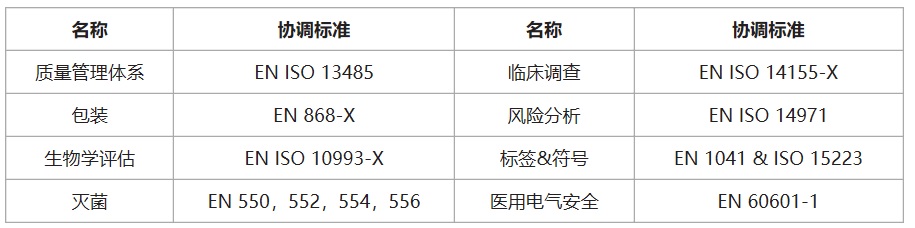
醫療器械CE認證之歐盟醫療器械協調標準:
杭州證標客醫藥技術咨詢有限公司是國內極少數提供醫療器械CE認證、進口醫療器械注冊全流程服務的機構之一。有任何需求,歡迎您隨時方便聯系葉工18058734169(微信同)。