注射器包材供應商發生變更����,包材材質和/或類型一致���,如何開展等同性研究���?
根據中國醫藥包裝協會T/CNPPA 3009—2020《藥包材變更研究技術指南》���,其研究過程可分為以下幾個步驟:
(1)基于先驗知識評估風險:若評估相關風險可接受時���,可認為等同性及相容性研究完成�����。
(2)若評估仍存在風險�,需開展進一步藥包材等同性實驗研究:
①結合藥包材質量標準或質量協議,以及藥品的性能和生產特性����,評估變更前后藥包材的保護性和功能性關鍵性能��;
②評價藥包材變更前后是否化學等同��。進行安全性評估:變更前后藥包材化學等同����,且體外細胞毒性試驗可接受(玻璃等無機材料無需進行生物學試驗),化學等同性研究結果可用于安全性評估��;變更前后的藥包材化學不等同��,需先定性定量分析新增加的提取物/浸出物����,再進行安全性評估(體內、體外生物學評價和可提取物/浸出物的毒理學風險評估)����;進行相容性研究:化學等同性研究和安全性評估可視為相容性研究的一部分�����,在此基礎上根據風險評估情況判斷是否需開展進一步的相容性研究����;對藥包材的等同性及相容性研究進行總結��,確定變更后藥包材是否可接受��。
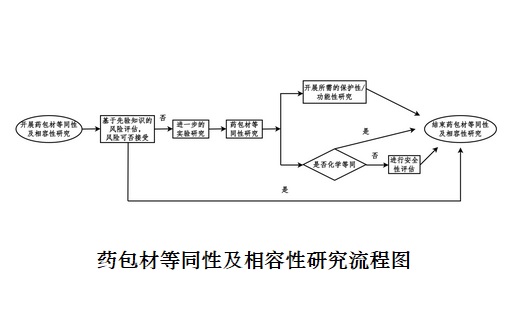
注:先驗知識可能包括:組件配方(如材料組成���、添加劑���、工藝助劑、催化劑����、抗氧劑��、色素等)�����、材料/組件的合規性�,如藥典或相關標準的符合性、生物反應性試驗����、TSE/BSE(傳播性海綿狀腦病/牛海綿狀腦病)聲明����、特殊關注物質無添加聲明�����、化學兼容性���、歷史提取研究數據及安全性評估數據��、組件生產工藝或預處理工藝(如滅菌�����、清洗��、硅化、表面處理)、材料/組件在藥品中的使用歷史(如已獲批上市制劑的處方工藝特性����、臨床使用信息)��、藥品處方工藝特性等�����。