Basic UDI-DI的要求已經(jīng)于2021年5月26日開始生效,廣大制造商需要盡快申請(qǐng)編碼并納入自身的MDR文件體系。歐盟的Basic UDI-DI是歐盟醫(yī)療器械法規(guī)中的一個(gè)概念,是器械類型的主要識(shí)別符,該代碼與UDI-DI不同。UDI-DI跟著產(chǎn)品走,體現(xiàn)在產(chǎn)品、包裝和標(biāo)簽上,實(shí)現(xiàn)的是產(chǎn)品追溯目的;而Basic UDI-DI跟著文件走,體現(xiàn)在證書、符合性聲明和技術(shù)文件中,實(shí)現(xiàn)的是文件對(duì)應(yīng)的產(chǎn)品組的識(shí)別。
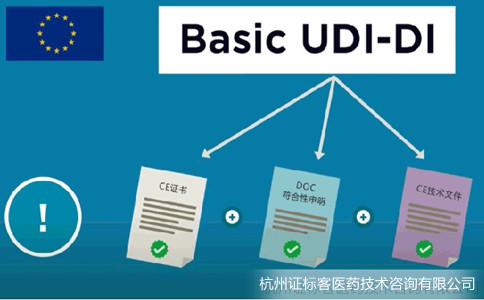
Basic-UDI申請(qǐng)流程和要求:
1.企業(yè)聯(lián)系GS1(就是中國的“中國物品編碼中心"”),付費(fèi),成為會(huì)員,得到"GS1 Company Prefix"。
2.企業(yè)給自己產(chǎn)品編一個(gè)"Internal number”。同類型的產(chǎn)品,生產(chǎn)工藝類似,預(yù)期用途相同,技術(shù)特性類似,可以分同一個(gè)代碼。
3.把兩組數(shù)字輸入到以下網(wǎng)頁,點(diǎn)擊"Calculate",就會(huì)得到Basic UDI。
但是企業(yè)申請(qǐng)到Basic-UDI與正確使用Basic-UDI之間還存在較大的差距,建議企業(yè)聘請(qǐng)如專業(yè)的Basic-UDI申請(qǐng)代理機(jī)構(gòu)辦理。
也歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)系,聯(lián)系人:葉工,18058734169,微信同。