X射線血液輻照儀�、X射線血液輻照設備在我國屬于第三類醫療器械注冊產品�,產品通常由主機����、控制系統、X射線發生裝置(雙源)、輻照容器���、冷卻系統組成,適用于血站或者醫院對袋裝全血類、紅細胞類和血小板類血液制品進行X射線輻照�����。近日國家藥監局發布《X射線血液輻照設備注冊審查指導原則(征求意見稿)》���,一起來了解法規動向��。
X射線血液輻照儀���、X射線血液輻照設備在我國屬于第三類醫療器械注冊產品��,產品通常由主機、控制系統��、X射線發生裝置(雙源)���、輻照容器���、冷卻系統組成�,適用于血站或者醫院對袋裝全血類、紅細胞類和血小板類血液制品進行X射線輻照���。近日國家藥監局發布《X射線血液輻照設備注冊審查指導原則(征求意見稿)》,一起來了解法規動向��。
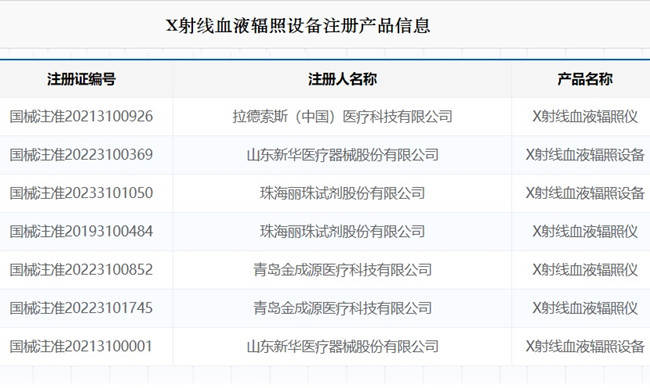
X射線血液輻照設備注冊審查指導原則(征求意見稿)
本指導原則旨在指導注冊申請人對X射線血液輻照設備注冊申報資料的準備及撰寫����,同時也為技術審評部門審查注冊申報資料提供參考。
本指導原則是對X射線血液輻照設備的一般要求,申請人應依據產品的具體特性確定其中內容是否適用�����。若不適用���,需具體闡述理由及相應的科學依據����,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。
本指導原則是供注冊申請人和技術審評人員使用的指導性文件���,但不包括審評審批所涉及的行政事項,亦不作為法規強制執行��,應在遵循相關法規的前提下使用本指導原則�。如果有能夠滿足相關法規要求的其他方法,也可以采用��,但是需要提供詳細的研究資料和驗證資料��。
本指導原則是在現行法規和標準體系以及當前認知水平下制定�����,隨著法規和標準的不斷完善����,以及科學技術的不斷發展,相關內容也將適時進行調整��。
一��、適用范圍
本指導原則所述的X射線血液輻照設備��,是指利用X射線源對血液樣品進行輻照的醫療器械。對于利用其他射線源對血液樣品進行輻照的設備���,如γ射線源,也可參考���。
二、注冊審查要點
(一) 監管信息
1.產品名稱
產品名稱建議使用通用名稱:X射線血液輻照設備���。
2.管理類別和分類編碼
參照現行《醫療器械分類目錄》,產品按第三類醫療器械管理��,分類編碼為10-01-04��。
3.注冊單元劃分
注冊單元劃分應符合《醫療器械注冊單元劃分指導原則》的要求����,原則上以產品的技術原理��、結構組成�����、性能指標和適用范圍為劃分依據,建議符合以下原則:
3.1主要組成部件不同
多射線源與單射線源產品�����,建議劃分為不同的注冊單元��。
3.2產品結構不同
X射線球管與輻照容器排布方式不同的產品,如并列排布����、類星體排布�,建議劃分為不同的注冊單元。
(二) 綜述資料
1.概述
描述申報產品的通用名稱及其確定依據���,描述產品的管理類別、分類編碼����。
如適用�,描述有關申報產品的背景信息概述或特別細節�����,如:申報產品的歷史概述����、歷次提交的信息���,與其他經批準上市產品的關系等�。
X射線血液輻照設備的產品設計開發應以臨床需求為導向,應能保證X射線血液輻照設備的輸入�、輸出��、評審、驗證、確認����、轉化����、更改等各環節的科學性和合理性���。重點對產品安全有效性和質量可控性進行確認��。產品設計應考慮醫療器械可用性工程的要求。
2.產品描述
2.1器械及操作原理描述
X射線血液輻照設備通過X射線發生裝置產生X射線,對輻照容器中的袋裝血液樣品進行輻照���,使血液樣品中具有免疫作用的淋巴細胞失去增殖活性,以此降低輸血相關移植物抗宿主病(TA-GVHD)的發生概率,得到臨床需要的輻照血液樣品����。
使用X射線血液輻照設備進行血液輻照的目的是預防輸血相關移植物抗宿主?���。═A-GVHD)的發生�����,X射線血液輻照設備一般用于國家衛生健康委員會發布的標準WS/T 623全血和成分血使用及《血站技術操作規程》中規定的需進行血液輻照的血液樣品及臨床適用情況�,輻照后血液樣品的質量控制要求與原血液樣品要求相同�����。
申請人需結合產品的臨床應用���,描述產品的工作原理�����,包括產品血液輻照技術的原理,X射線發生裝置的原理,X射線作用于淋巴細胞損傷DNA的作用機理等�。
2.2結構及組成
2.2.1產品整體描述
X射線血液輻照設備一般由X射線發生裝置、屏蔽裝置���、輻照容器、旋轉機構���,冷卻系統(如有)及控制系統組成。申請人需提供產品整體描述資料��,可以結合產品的結構組成對產品進行描述�,提供產品外觀構造、完整系統的詳細描述��。
申請人需提供產品機房布局圖����,提供產品實物圖示�����、系統框圖以及各部件之間連接關系圖示,輻照源與輻照容器的位置排布圖�����,并標識關鍵部件/組件�,提供詳細說明。
申請人需提供與產品物理性能相關的設備屬性的完整描述���,需包含整個系統及系統各部件的技術特性、性能參數和規范�。
申請人需提供相對于已上市同類產品的創新性技術��、設計、應用的詳細介紹����。例如:采用直線加速管來代替常規X射線球管作為X射線放射源等��。
2.2.2產品部件
申請人需提供產品各部件的詳細描述,包括各部件的工作原理、結構組成�、主要功能及性能參數等。
2.2.2.1 X射線發生裝置
X射線發生裝置為產品的核心部件�,需明確X射線管的數量�����,提供X射線管及高壓發生器的型號、供應商及物理參數��。
2.2.2.2 屏蔽裝置
屏蔽裝置包括X射線管屏蔽體及輻照室屏蔽體��,需提供屏蔽裝置的結構圖示�����,說明屏蔽體結構設計、材質�、厚度以及厚度設定的計算方法�����,所能達到的屏蔽效果。
2.2.2.3 輻照容器
說明輻照容器的固定方式��,明確輻照容器的數量��、材質��、尺寸(高度、內外徑)���、容量,及滿載所能容納的血袋數量、規格�����。
2.2.2.4 旋轉機構
提供旋轉機構的結構圖示���,說明旋轉機構結構設計��、傳感器及旋轉方式、方向、轉速��。
2.2.2.5 冷卻系統(如有)
冷卻系統一般不建議放入輻照設備的結構及組成進行申報���,產品內置的冷卻系統除外�。如有,需明確冷卻系統的冷卻類型,冷卻介質以及冷卻參數(流量���、溫度等)。
2.2.2.6 控制系統
一般包括硬件部分及控制軟件,說明硬件部分的性能參數,說明軟件功能,如輻照功能、警示/提示功能等���。
2.3型號規格
申請人需明確申報產品的型號規格,提供產品配置表。若申報產品包含多種型號規格����,需要說明各型號規格之間的產品配置差異�����。
2.4參考的同類產品或前代產品的情況
申請人需列表比較說明申報產品與同類產品或前代產品的差異���,對比內容需要包括產品的工作原理�、結構組成�����、制造材料����、性能指標�、適用范圍、臨床功能和產品技術特征等方面��,并重點描述申報產品的新技術���、新特征和新功能��。
3.適用范圍
3.1適用范圍
申請人需說明申報產品可以提供的射線種類(X射線)和適用的輻照對象,例如:
該產品適用于血站或者醫院對袋裝全血類、紅細胞類和血小板類血液樣品進行X射線輻照�。
3.2預期使用環境
申請人需明確對設備使用環境的要求����。
使用環境的要求至少應包括溫度���、濕度�、大氣壓、電源條件等����。
(三) 非臨床資料
1.風險管理
申請人需提供產品的風險管理資料����,包括詳細說明風險分析����、風險評價、風險控制、剩余風險可接受性�����、風險綜合評價等重要內容�����。按照GB/T42062標準的要求�,結合X射線血液輻照設備的安全特征��,從能量危險(源)�、生物學和化學危險(源)���、生物相容性危險(源)�、操作危險(源)�、信息危險(源)等方面,對產品風險進行全面分析并闡述相應的防范措施���,產品建議重點關注的主要風險可參考附件1。
2.醫療器械安全和性能基本原則清單
申請人需提供《醫療器械安全和性能基本原則清單》����,說明申報產品為符合適用的各項要求所采用的方法����,以及證明其符合性的文件�。對于不適用的各項要求,申請人需要詳細說明理由�。
3.產品技術要求及檢驗報告
3.1申報產品適用標準情況
X射線血液輻照設備宜參考的標準見表1���。
表1 X射線血液輻照設備適用的標準
GB 4793.1 | 測量����、控制和實驗室用電氣設備的安全要求 第1部分:安全通用要求 |
GB/T 18268.1 | 測量�����、控制和實驗室用的電設備 電磁兼容性要求 第1部分:通用要求 |
YY /T 1834 | X射線血液輻照設備 |
3.2產品技術要求
需按照《醫療器械產品技術要求編寫指導原則》編制產品技術要求�����。產品技術要求示例見附件2�����。
產品技術要求性能指標可參照YY /T 1834的相關要求����,結合產品特征進行制定,具體性能指標參見附件2�,對于需制造商規定的參數�����,需依據產品實際應用情況,在性能指標條款中列明相關參數的具體數值��,例如:數量��、規格�、范圍及誤差等���。
3.3檢驗報告
檢驗報告需注明產品型號規格或配置����,樣品描述應與產品技術要求的部件名稱和型號等信息保持一致。
檢驗報告需要提供軟件版本界面的真實照片或列明軟件版本信息���。具有用戶界面的軟件需要體現軟件發布版本和軟件完整版本,無用戶界面的軟件需要體現軟件完整版本��。
3.3.1同一注冊單元的典型檢驗產品
申請人需按照注冊單元進行產品檢驗���,檢驗結果需要覆蓋注冊單元內所有產品型號規格或配置�。典型檢驗產品需要考慮結構組成、性能指標���、預期用途等,一般選取功能最齊全�,結構最復雜����,輻照杯數量最多�、體積最大��,風險最高的產品型號規格或配置����,并提供檢驗典型性說明���。
3.3.2產品電磁兼容檢驗
申請人需提供電磁兼容檢驗中產品運行模式的選取依據�����,如待機模式�����、輻照運行最大發射模式及輻照運行典型模式等。需考慮產品基本性能,如根據風險評估無基本性能可進行說明。根據標準要求進行電磁兼容檢驗����。
3.3.3關于檢驗情況的說明
申請人可以提供檢驗情況說明和檢驗報告清單�,描述檢驗報告對應的產品型號規格/配置和檢驗類型(產品性能和安規檢驗��、電磁兼容檢驗等)�。
4.研究資料
根據產品的適用范圍和技術特征���,提供非臨床研究綜述���,逐項描述所開展的研究��,概述研究方法和研究結論��。根據非臨床研究綜述�,提供相應的研究資料����,各項研究可通過文獻研究��、實驗室研究��、模型研究等方式開展,一般應當包含研究方案��、研究報告�����。采用建模研究的�,提供產品建模研究資料����。
4.1化學和物理性能研究、電氣系統安全性研究
申請人需提供產品性能研究資料,以及產品技術要求的編制說明,列表說明產品性能指標的確定依據、設計輸入來源以及臨床意義,所采用的標準或方法�����、采用的原因及理論基礎���。
申請人需說明適用的標準或方法���,解釋引用或采用的理由�。關于適用標準中的不適用條款,需要提供必要的說明��。
申請人需按照YY /T 1834的要求�����,提供輻照容器吸收劑量研究�。包括不限于:
(1)提供相同輻照條件下��,輻照容器滿載狀態,空載或最小負載狀態下吸收劑量分布圖研究�。
(2)提供輻照容器滿載狀態下�����,參考點吸收劑量準確性的研究,其偏差值應≤10%��。
(3)提供輻照容器滿載狀態下��,輻照容器內吸收劑量均勻性的研究�����,任意位置之間的偏差值應≤30%。
(4)提供輻照容器滿載及最小負載狀態下���,輻照容器任意位置的樣品吸收劑量研究,任意位置的吸收劑量值均應在25Gy-50Gy范圍內��。
申請人需提供與聯合使用器械的研究資料�。如聯合使用的血袋,血袋需符合標準GB 14232.1的要求�,輻照血液血袋需粘貼血液輻照指示卡�����,需明確血袋的材質,并提供輻照對血袋包材不產生影響的研究驗證�。
4.2輻射安全研究
申請人可按照YY /T 1834提供輻射安全的研究資料�,包括不限于:
(1)提供待機及最大輻照劑量工作狀態下雜散輻射研究���,距輻射源1m處����,雜散輻射劑量當量率應不超過1μSv/h。
(2)提供待機及最大輻照劑量工作狀態下泄露輻射研究,輻照設備可觸及表面50mm處任意位置的泄漏輻射劑量當量率應不超過2.5μSv/h��。
4.3軟件研究
X射線血液輻照設備進行輻照時���,如果輻照門連鎖功能失效�����,可能會出現開啟輻照門未停束的情況�����,給操作者帶來嚴重的傷害。因此�����,X射線血液輻照設備的軟件安全性級別一般為嚴重級別��。
申請人需按照《醫療器械軟件注冊技術審查指導原則(2022修訂版)》的要求提交軟件研究資料����。如適用�����,按照《醫療器械網絡安全注冊技術審查指導原則(2022修訂版)》的要求提交網絡安全研究資料��。
4.4清潔、消毒研究
該產品與患者不接觸,常規情況下進行低水平消毒即可�����,若有血液泄露造成污染的情況����,需要進行徹底清潔���,然后根據污染的性質和程度進行中等水平或低水平消毒���。申請人需明確推薦的清洗和消毒工藝(方法和參數)��、工藝的確定依據以及驗證資料����。
4.5可用性研究
注冊申請人需參照《醫療器械可用性工程注冊審查指導原則》���,按照中使用風險醫療器械要求提交使用錯誤評估報告���,包括基本信息����、使用風險級別、核心要素�、同類醫療器械上市后使用問題分析���、使用風險管理��、結論等內容。
4.6穩定性研究
4.6.1使用穩定性
申請人需按照《有源醫療器械使用期限注冊技術審查指導原則》���,提供產品使用期限的研究資料,產品老化研究后需進行符合產品技術要求的整機性能驗證�。對于某些可更換部件��,可單獨確定其使用期限。如X射線管組件。
4.6.2運輸穩定性
申請人需提供運輸穩定性和包裝研究資料��,證明在申請人規定的運輸條件下�,運輸過程的環境條件(例如:震動����、振動、溫度和濕度的波動)不會對醫療器械的安全性和有效性�,包括完整性和清潔度��,造成不利影響。
4.6其他研究
申請人需提供基于真實人體血液樣品的輻照安全性和有效性的研究報告����,研究輻照對血液成分的影響��,輻照后的血液樣品需符合GB 18469的質量要求�����。申請人應分析影響輻照效果的影響因素,如不同輻照容器規格�,血液樣品負載情況��,不同輻照參數等,需考慮輻照容器的大小�����、輻照容器內血液樣品的排布方式�、負載量、輻照劑量范圍�、劑量率���、輻照時間等的對輻照安全性和有效性產生影響的最不利情況�����,并分別開展真實血液樣本試驗。對于不同的血液樣品類型�����,每組血液樣品類型試驗至少需要5例不同健康獻血者的血液����。對于輻照血液樣品類型的選取���,申請人需說明輻照血液樣品類型選取充分的理由����,可參照標準WS/T 623全血和成分血使用及《血站技術操作規程》中對于需進行輻照的血液類型要求,結合適用范圍的宣稱進行確定�,一般可包括以下幾類:
(1)全血
全血類型包括全血及去白細胞全血���,申請人可從白細胞含量及臨床應用情況等方面���,進行充分的選取類型典型性分析����,如全血�����。
(2)紅細胞
紅細胞類型包括濃縮紅細胞���,濃縮去白紅細胞���、懸浮紅細胞�、去白懸浮紅細胞����、洗滌紅細胞及冰凍解凍去甘油紅細胞�。申請人可從是否需要輻照、白細胞含量及臨床應用情況等方面,進行充分的選取類型典型性分析�����,如懸浮紅細胞����。
(3)血小板
血小板類型包括濃縮血小板、混合濃縮血小板、單采血小板及去白單采血小板。申請人可從白細胞含量及臨床應用情況等方面����,進行充分的選取類型典型性分析����,如單采血小板。
(4)其他
申請人需根據適用范圍的宣稱,進行血液樣品類型選取��。如單采粒細胞����。
X射線輻照對血液成分影響的研究內容示例可參考附件3。
(四) 臨床評價要求
產品不屬于免于進行臨床評價目錄中的產品����,申請人需按相關臨床評價指導原則開展臨床評價���。
(五) 產品說明書和標簽樣稿
產品的說明書��、標簽應當符合《醫療器械說明書和標簽管理規定》及其他適用標準的要求(如:GB 4793.1、GB/T 18268.1���、YY /T 1834等中關于說明書和標簽標識方面的要求)。其中說明書中應特別注意的地方有:
1. 注冊申請人宜根據產品具體功能����,確定其臨床適用范圍,參照國家衛生健康委員會發布的標準 WS/T 623全血和成分血使用、《血站技術操作規程》等相關文件的規定�����,明確進行輻照的血液樣品類型����、適應證和禁忌證。
2. 申報產品使用過程中��,有關電子輻射的防護措施�,建議提示使用者予以特別注意。
3. 明確輻照容器滿載狀態及最小負載狀態的說明和要求��,如血袋數量��、規格及放置方式���。
4. 明確需配用符合標準GB 14232.1的血袋的說明����,明確血袋輻照標識的說明和提示��。
5. 明確使用人員資質要求���,該產品使用場景為血站或醫院����,操作者需接受系統使用培訓�。
6. 建議說明關鍵部件更換周期、維護周期��,如X射線管組件�、冷卻系統(如有)。
7. 建議明確推薦的清潔和消毒方法����。
8. 建議提供單獨章節,描述申報產品的主要技術指標����。
(六) 質量管理體系文件
按照《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》的要求提交質量管理體系文件����。
三����、參考文獻
略